

依据器审中心(CMDE)
1.关于发布《医疗器械分类目录》子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号)
2.关于发布《医疗器械分类目录》子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号)
北京龙惠科技整理关于发布《医疗器械分类目录》中产品临床评价路径需临床试验产品汇总清单如下:
一、《医疗器械分类目录》子目录02“无源手术器械”
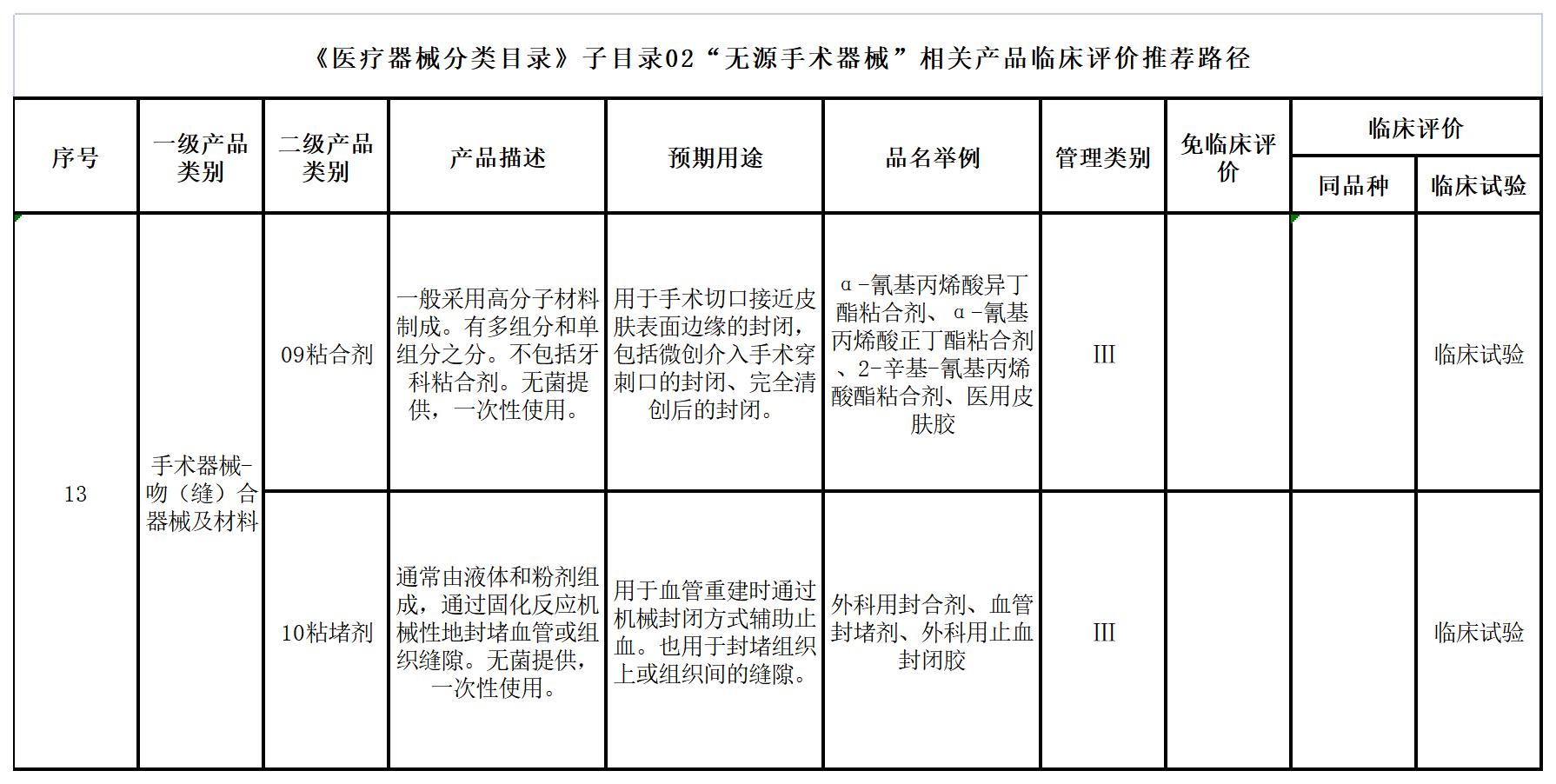
二、《医疗器械分类目录》子目录03“神经和心血管手术器械”
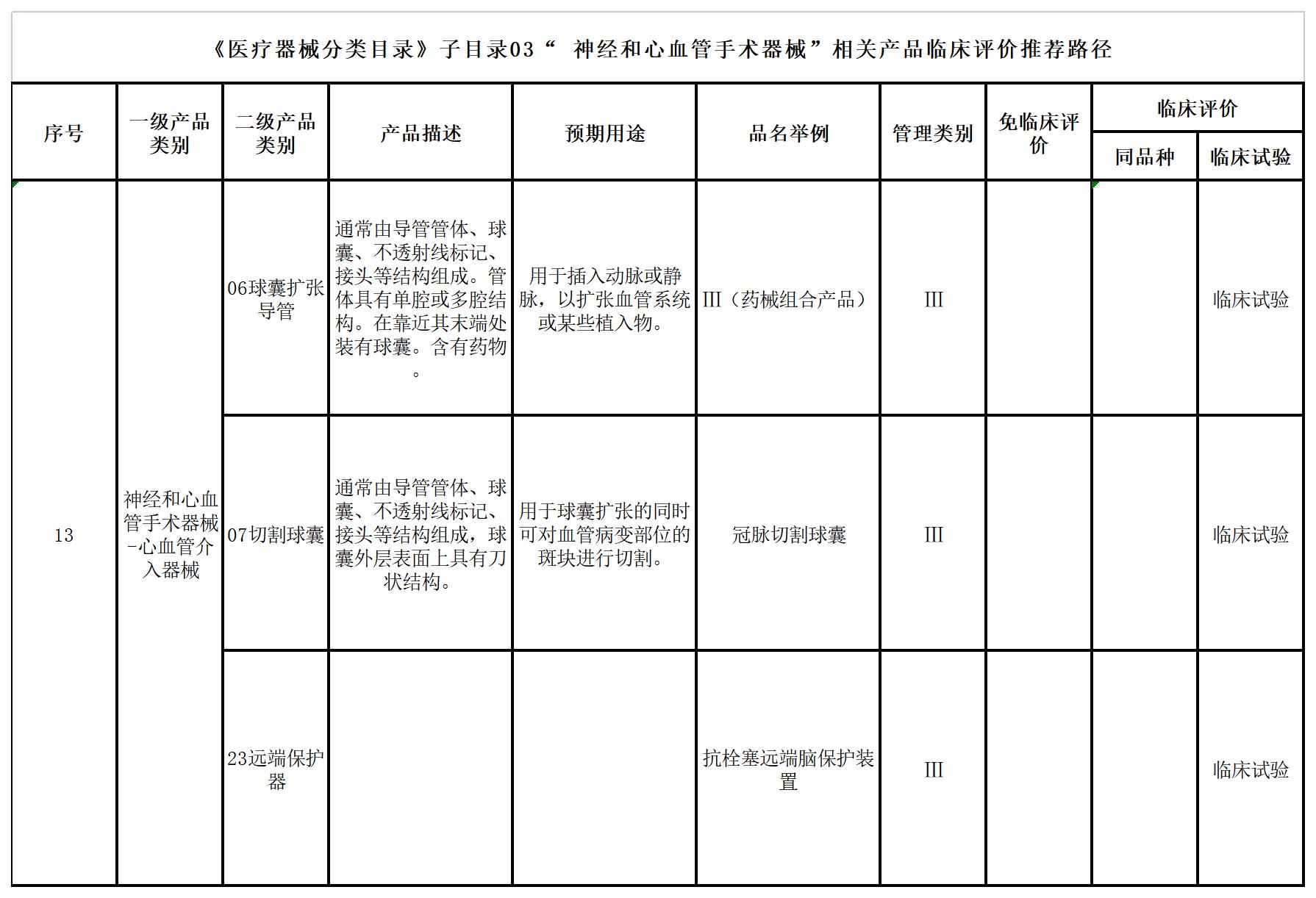
三、《医疗器械分类目录》子目录05“放射治疗器械”
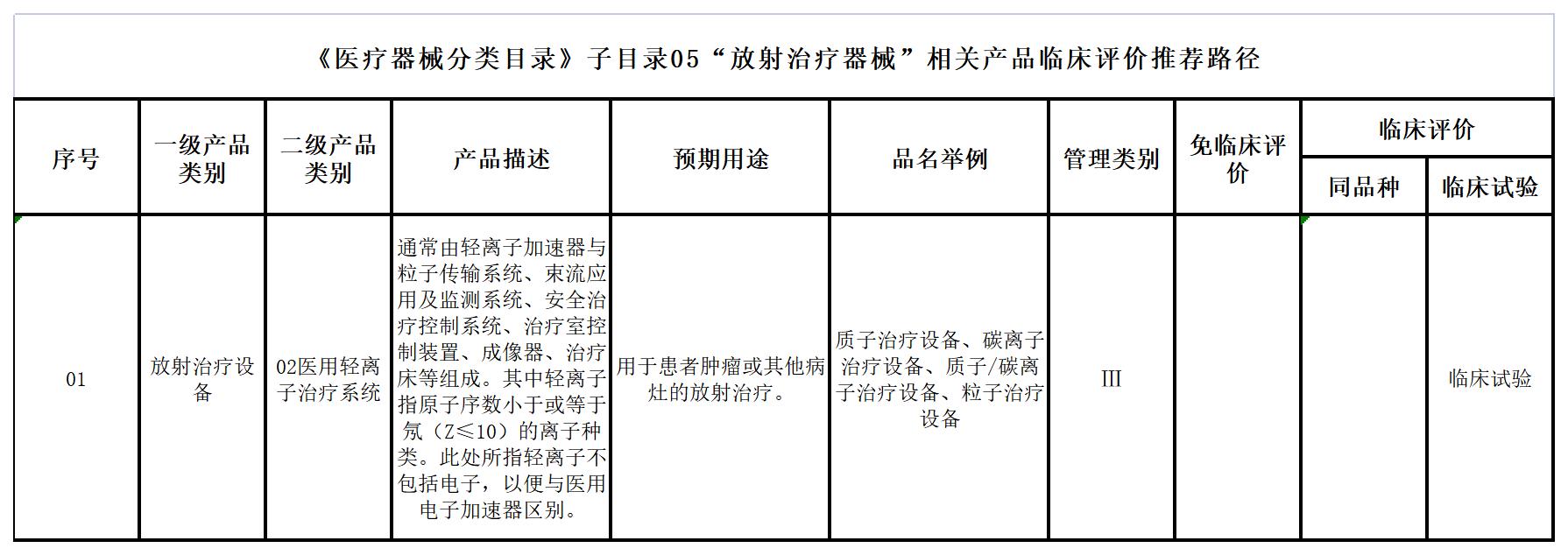
四、《医疗器械分类目录》子目录06“医用成像器械”
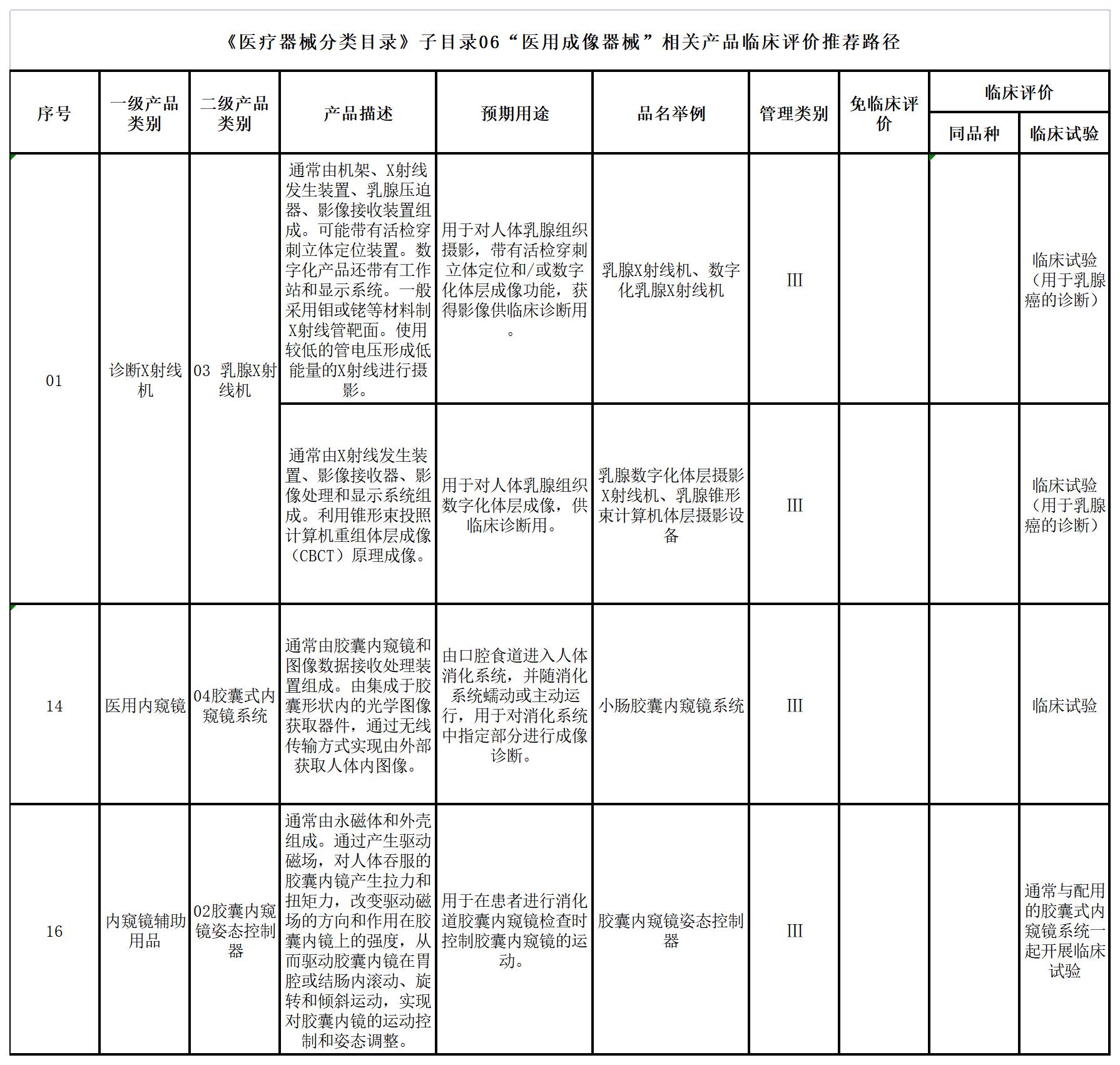
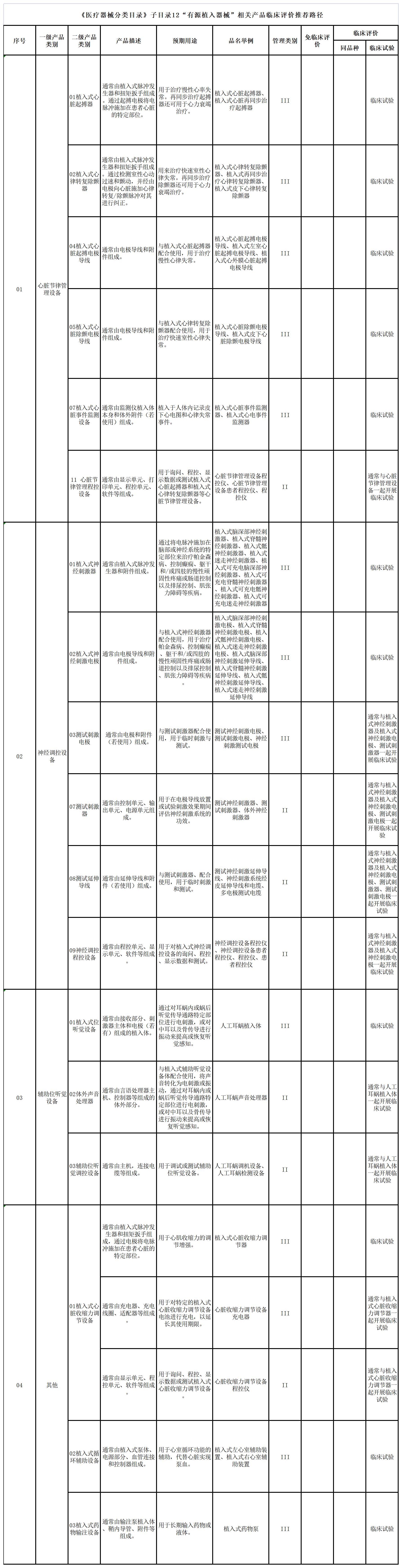
五、《医疗器械分类目录》子目录12“有源植入器械”
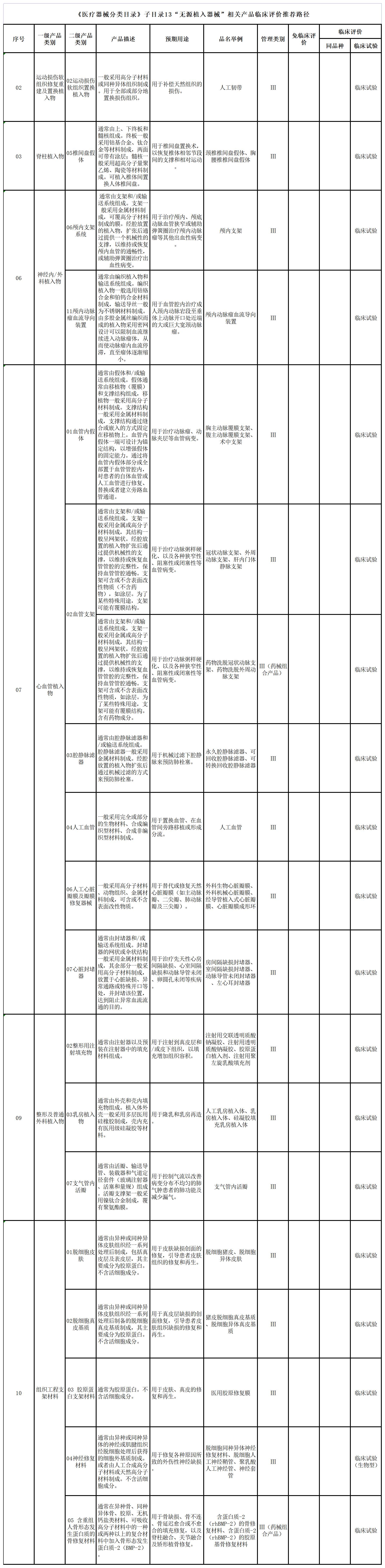
六、《医疗器械分类目录》子目录13“无源植入器械”
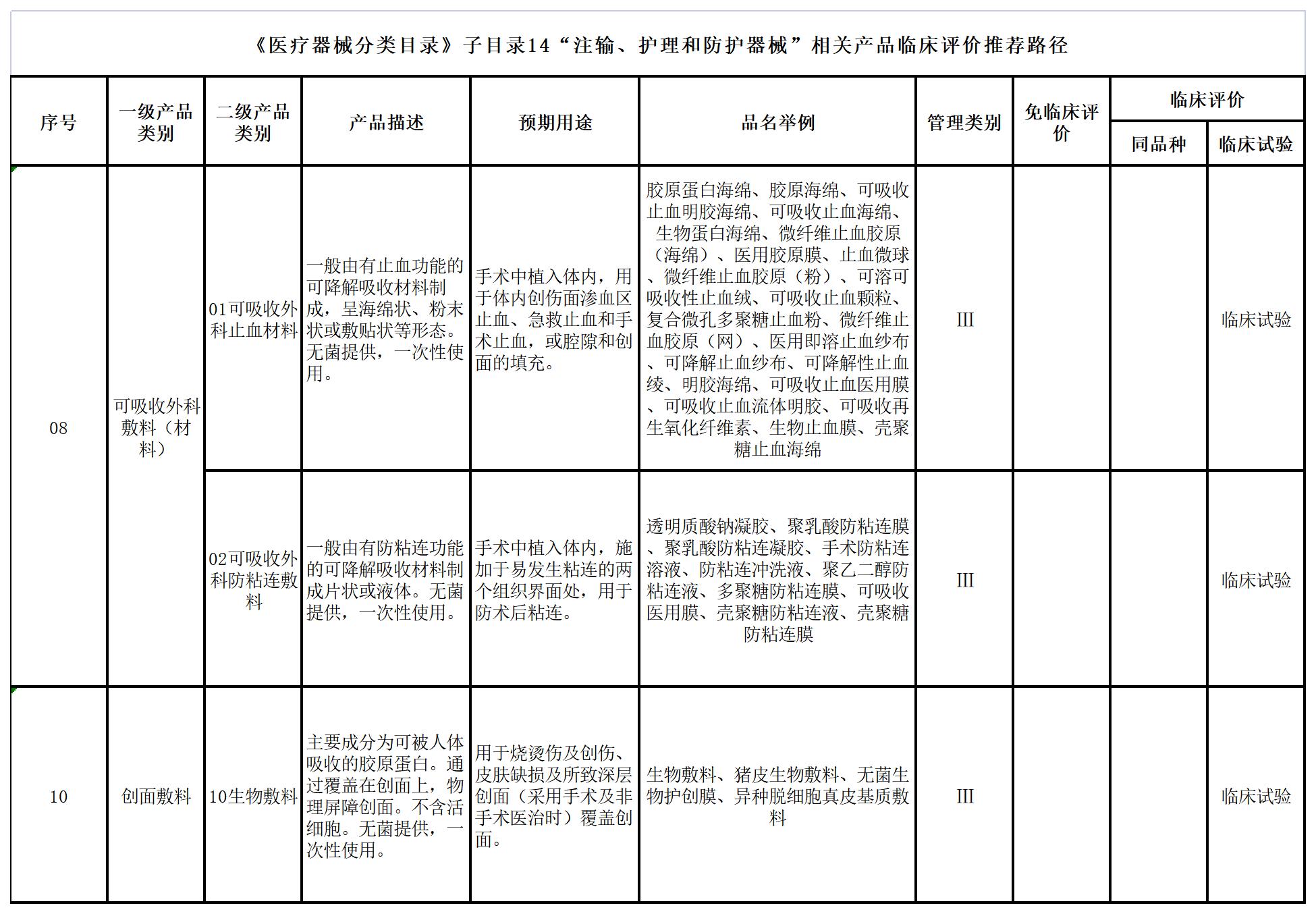
七、《医疗器械分类目录》子目录14“注输、护理和防护器械”
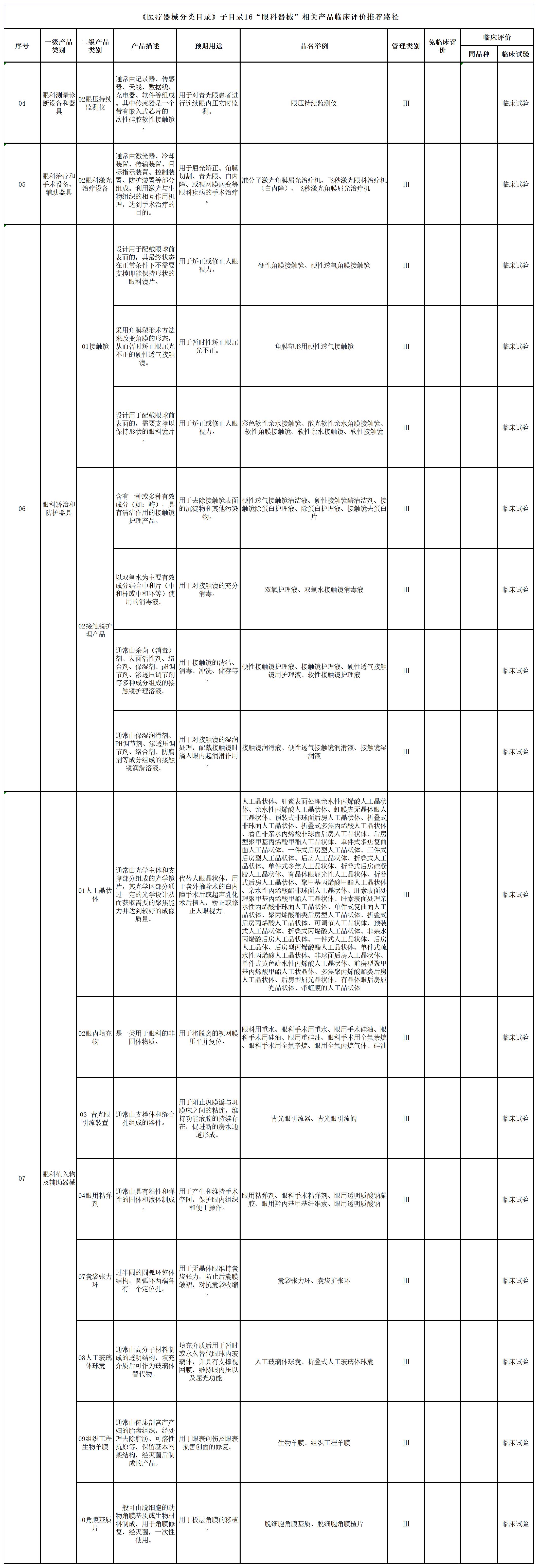
八、《医疗器械分类目录》子目录16“眼科器械”
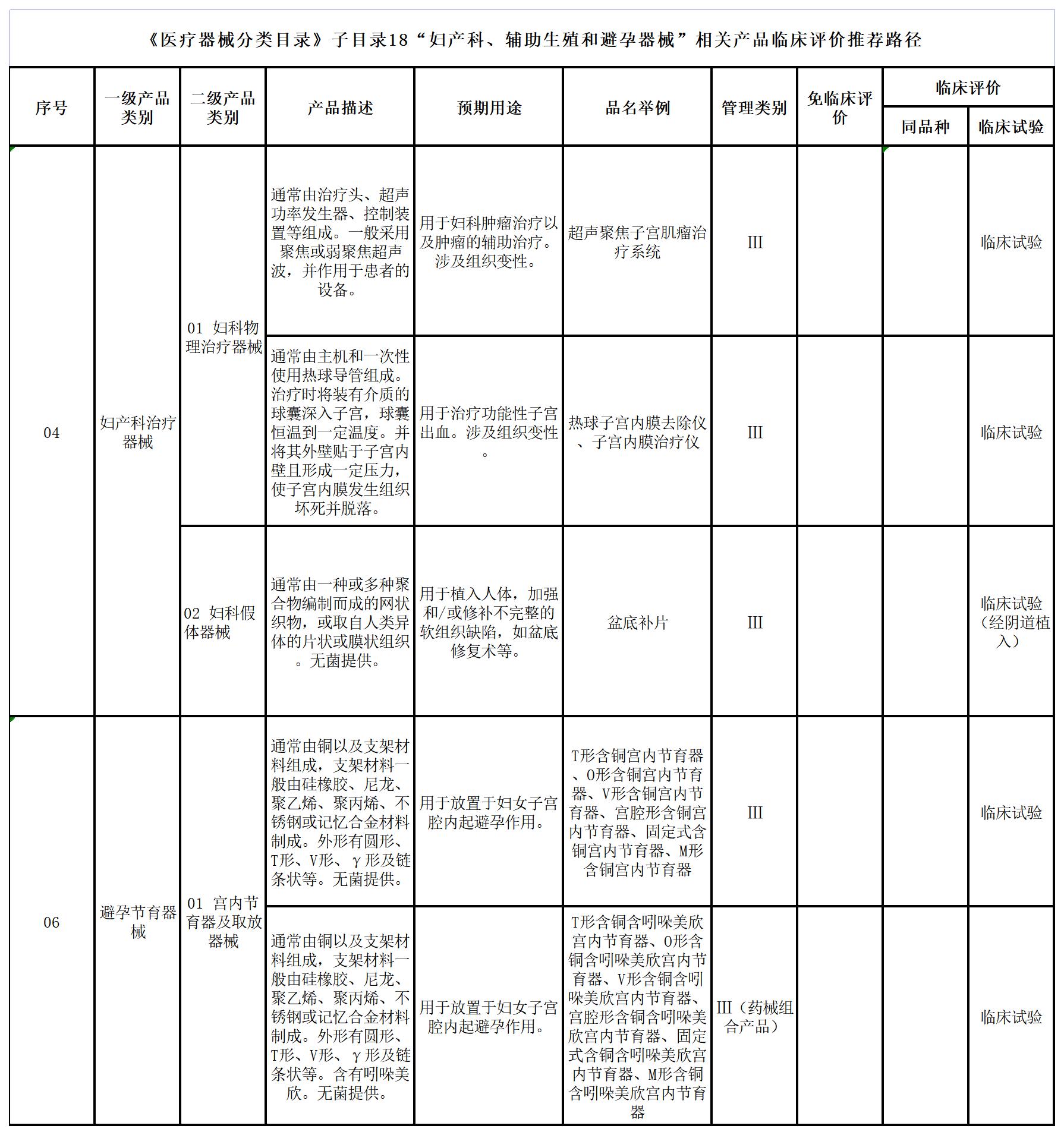
九、《医疗器械分类目录》子目录18“妇产科、辅助生殖和避孕器械”
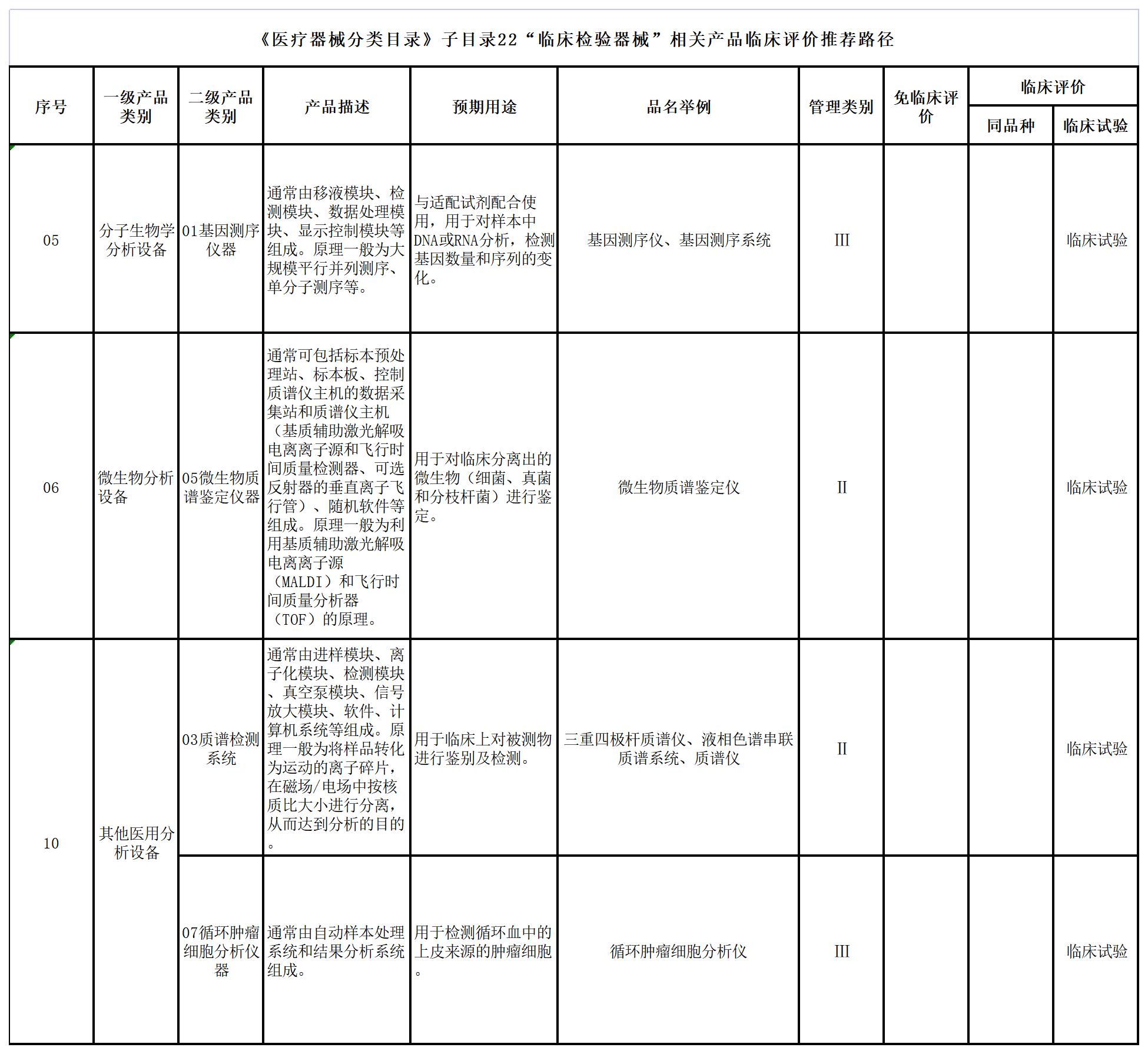
十、《医疗器械分类目录》子目录22“临床检验器械”
文章来源于CMDE,全文由北京龙惠科技整理,了解更多关于医疗器械注册、医疗器械临床试验,临床评价撰写服务,欢迎咨询北京龙惠科技。
