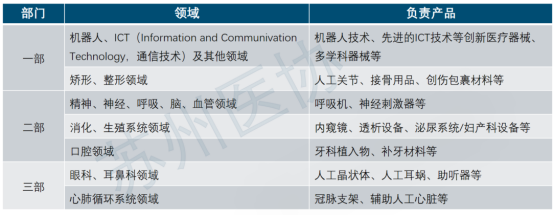
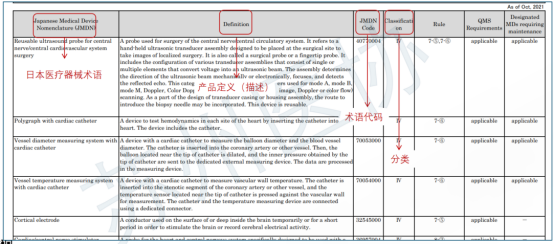
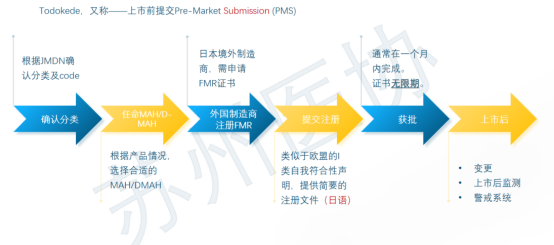
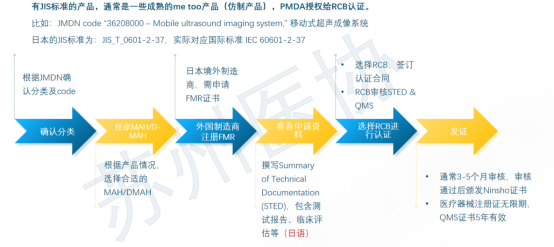
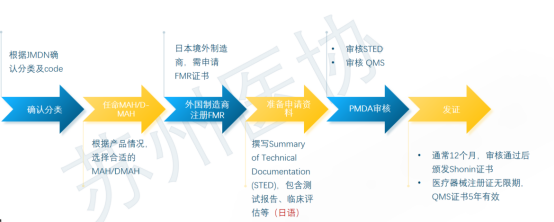
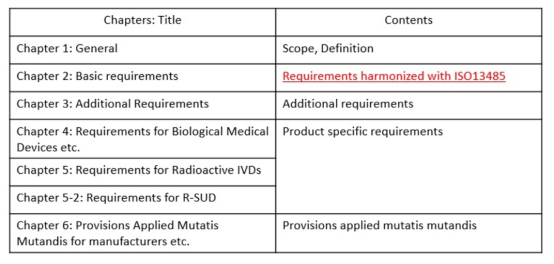
日本医疗器械法规概述 日本医疗器械分类 不同风险等级的产品,有不同的准入路径。 对于低风险Class I类产品,在日本遵循Todokede路径,又称上市前提交Pre-Market Submission (PMS)路径。PMS路径下,医疗器械的上市责任人,需要在日本药监局备案,通知到药监局,产品准备上市。药监收到通知后,一般会即时审批。加上准备资料的时间,整个Todokedo的周期大概就是一个月左右。流程如下图所示: 对于Class II、III类产品,如果该产品在日本有独立的行业标准(JIS标准),比如JMDN code “36208000 – Mobile ultrasound imaging system,” 移动式超声成像系统,该产品的日本JIS标准为:JIS_T_0601-2-37,实际对应国际标准 IEC 60601-2-37。在这种情况下,II、III类产品遵循Ninsho路径,Pre-Market Certificate,PMC。PMC路径下,PMDA把审核权利开放给第三方认证机构RCB,医疗器械的上市责任人,向RCB提交认证申请,RCB对责任人发起技术文档和质量管理体系的审核。审核通过,则发放注册证书。即。流程如下图所示: 对于没有日本行业标准JIS的II、III类产品,审核权依然在PMDA手中。他们的注册路径,和Class IV类产品一样,遵循Shonin路径,Pre-Market Approval,PMA。PMA路径下,医疗器械的上市责任人,向PMDA提交审核申请,PMD对责任人发起技术文档和质量管理体系的审核。审核通过,则发放注册证书。流程如下图所示: 日本医疗器械的上市,需要指定一名上市许可持有人Marketing Authorization Holder(MAH)。对于中国的制造商,通常有两种常见形式:MAH和D-MAH(Designated Marketing Authorization Holder)。 MAH模式下,中国制造商委托一家在日本成立的法人单位为上市许可持有人,同时是产品注册的申请人、注册人持有人。因此,MAH对产品的生产、上市商业化有控制权,同时对产品的合规负责。 D-MAH模式下,中国制造商委托一家在日本成立的法人单位为指定上市许可持有人,只在产品注册期间和上市后承担中国制造商代表。产品注册的申请人、注册证的持证人仍然是中国制造商,但需履行必要的质量控制责任。 两种模式各有利弊,取决于公司规模、日本当地经销商的合作模式等。 日本后生劳动省省令169号(MO 169)规定了医疗器械和体外诊断器械的质量管理体系要求。MO 169以ISO 13485为基础,并结合日本情况,做了适当调整,2004年首次发布,后经过了多次修订。最新的MO 169内容如下: