近期,云南、四川,山东等多地发布2024年医疗器械检查计划,重点品类、企业、医疗机构名单公布。
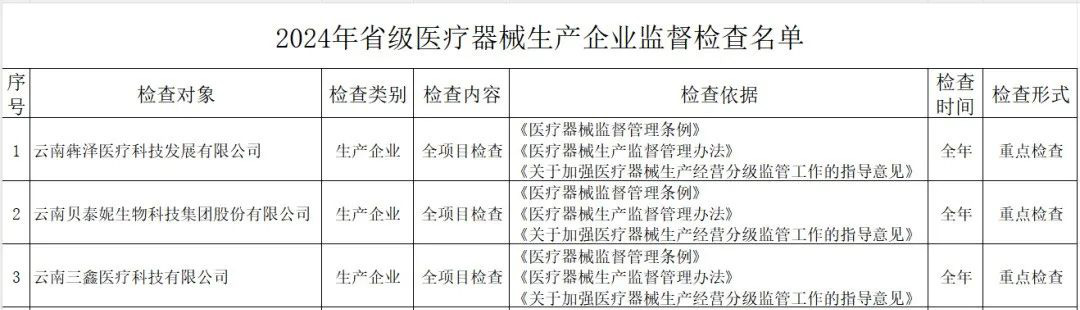
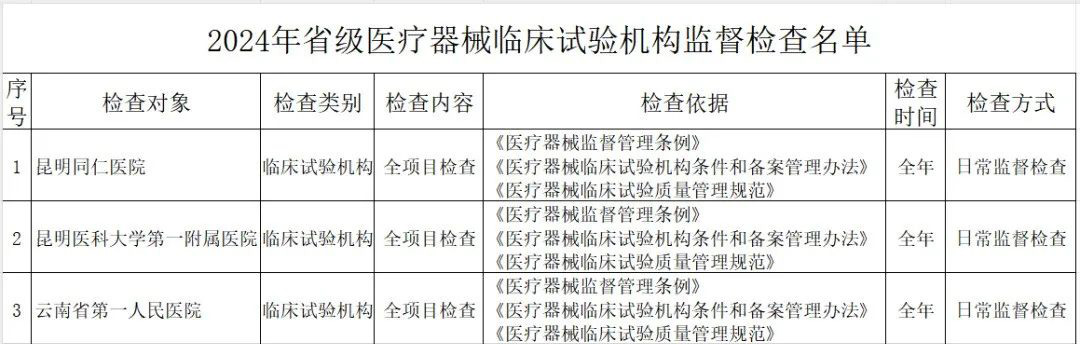
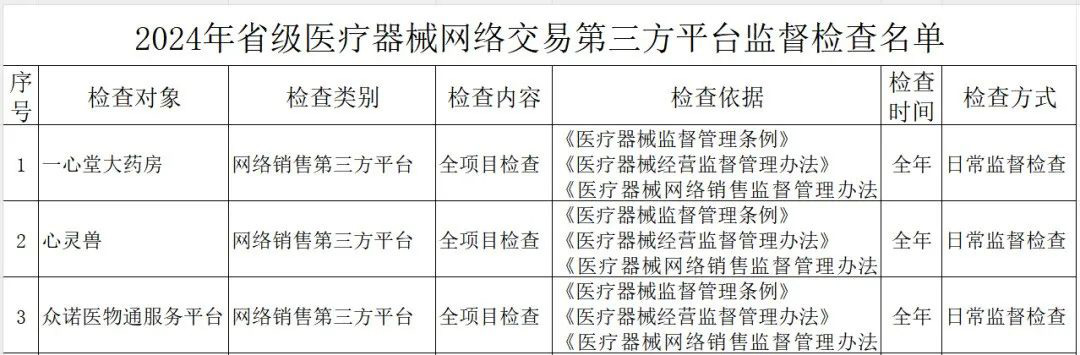
其中,云南省药监局发布了《2024年省级医疗器械监督检查计划》,检查范围包括医疗器械生产企业、医疗器械临床试验机构及医疗器械网络交易第三方平台,其中公布了详细的检查名单。
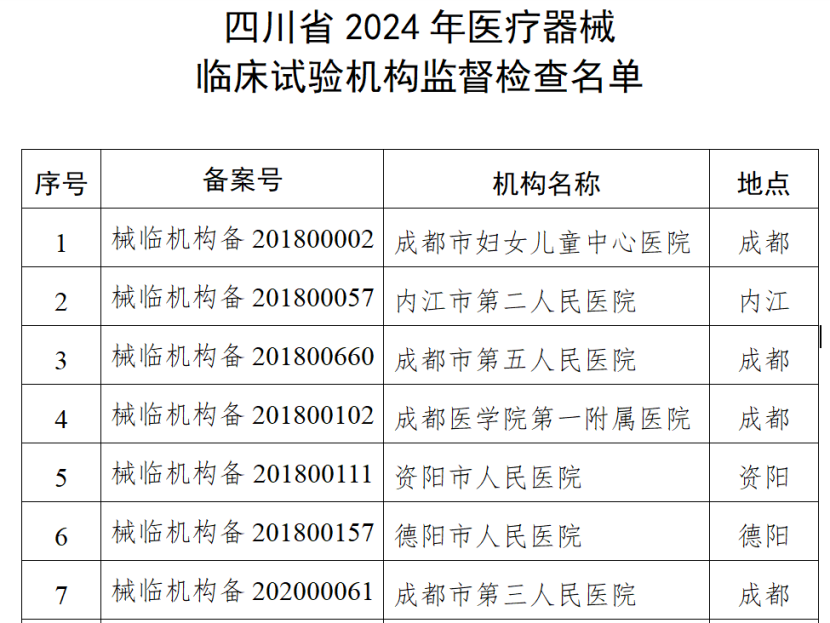
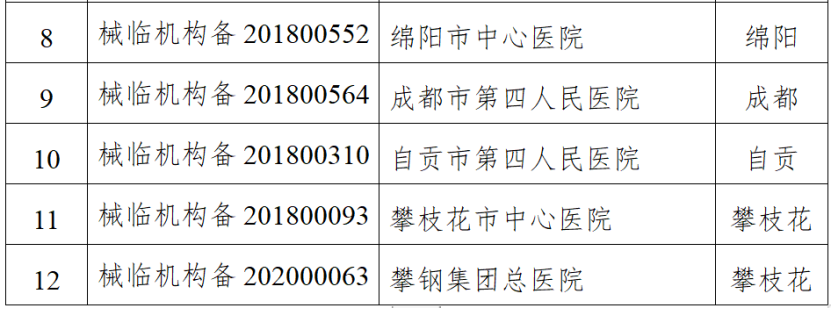
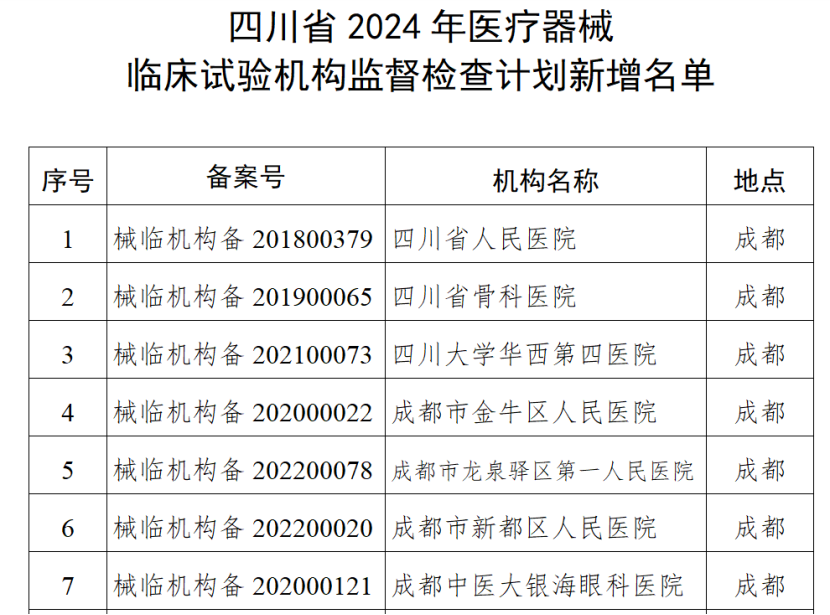
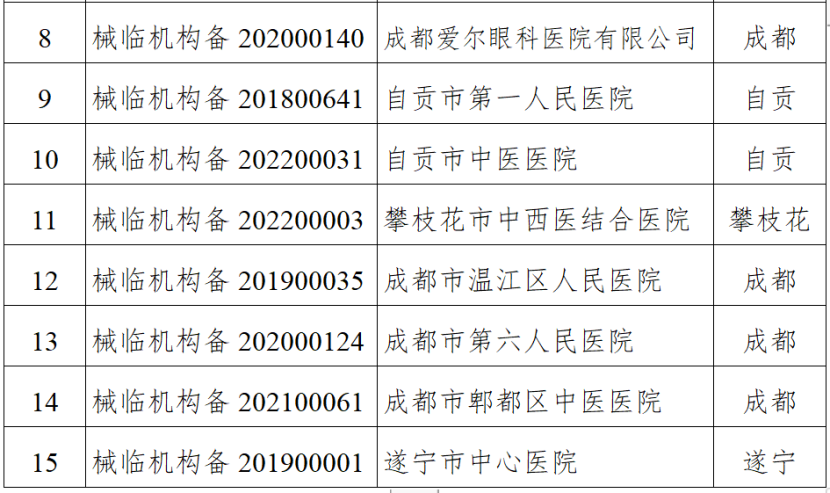
(一)医疗器械生产企业。包括生产风险分级为一般风险、较高风险和高风险的生产企业。对风险分级为高风险的医疗器械生产企业实施四级监管,每年全项目检查不少于一次;对风险分级为较高风险的医疗器械生产企业实施三级监管,每年检查不少于一次,其中每两年全项目检查不少于一次;对风险分级为一般风险的医疗器械生产企业实施二级监管,每两年检查不少于一次。(二)医疗器械临床试验机构。抽取云南省辖区内50%的临床试验机构开展GCP全项目监督检查。监督检查应在2024年11月30日前完成,并于2024年12月10日前将检查情况报云南省药监局医疗器械处。《检查计划》明确,坚持问题导向,针对突出问题和监管风险,将日常监督检查、飞行检查、专项检查有机结合,综合运用监督检查、监督抽检、不良事件监测、稽查执法、投诉举报等形式强化监督管理,不断压实企业主体责任,坚决守住医疗器械质量安全底线。山东省药监局印发《2024年全省医疗器械生产企业监督检查计划》,部署开展2024年医疗器械生产检查工作。其中明确,加强对集采中选、无菌和植入类、医用防护类、医疗美容、青少年近视防治、辅助生殖、体外诊断试剂、避孕套、创新医疗器械等重点产品和既往发现问题较多、抽检不合格、间歇生产、风险较高的委托生产等问题。四川省药监局发布《关于增加2024年四川省医疗器械临床试验机构监督检查家次的通告》,新增15家医疗器械临床试验机构,列入2024年度医疗器械临床试验机构监督检查计划。
整体来看,医疗器械监管强度明显加大,对违法违规行为的惩治也更趋严格。


![]()