为进一步规范医疗器械产品分类界定工作,结合我国医疗器械产品分类界定实际情况,国家药监局组织修订发布了《关于规范医疗器械产品分类界定工作的公告》(以下简称《公告》),自2024年9月1日起施行。
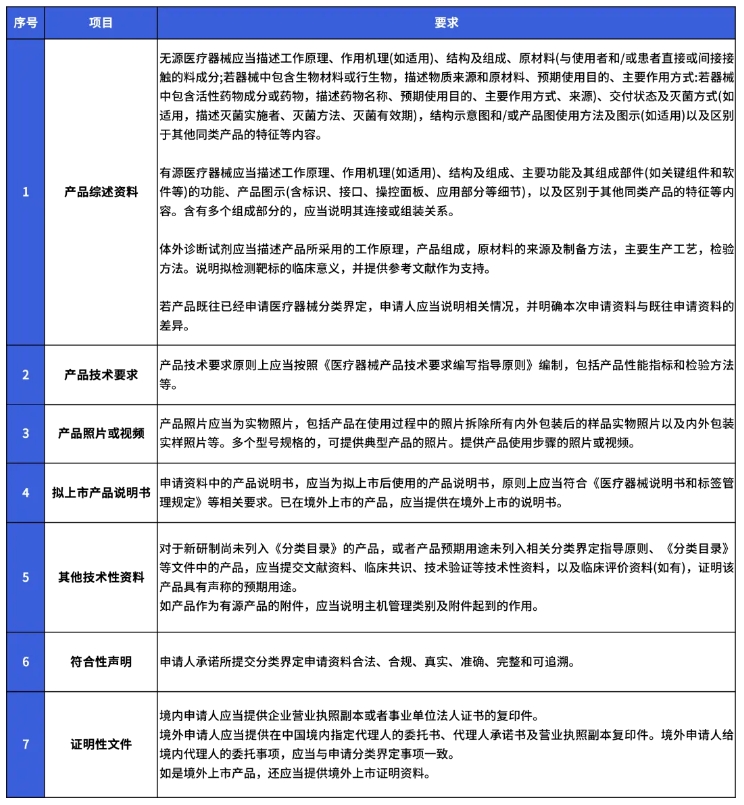
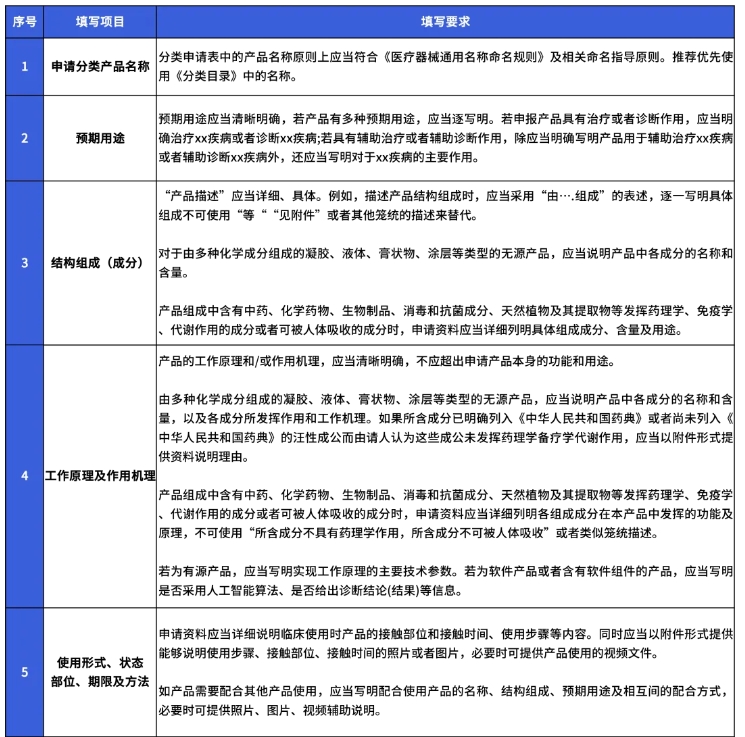
该公告进一步明确细化了分类界定申请资料的提交要求。并对《医疗器械分类界定申请表》填报要求的具体表述方法和提供形式,进行了逐一解释。详情如下:

《关于规范医疗器械产品分类界定工作的公告》共分为三部分,第一部分明确了分类界定工作的定位、开展分类工作的目的和依据、参与分类工作的各方职责等相关内容;第二部分规定了在产品备案、产品注册申请受理、技术审评、监管稽查、突发公共卫生事件应急所需、药械组合产品、创新医疗器械等其他情形中,涉及分类界定工作的原则要求;第三部分规定了分类信息化建设、指导省级药品监督管理部门分类界定工作、细化分类指导原则以及分类目录动态调整的原则性要求。