随着材料技术、信息网络技术、人工智能的快速发展及其在医药领域的应用日益增多,药械组合产品的研发和应用成为药品和医疗器械行业发展的重要方向之一。据Mordor Intelligence药械组合产品市场规模预计将从2023年的1257.0亿美元增长到2028年的1666.3亿美元,年复合增长率为5.80%。
1、产品定义
2、工作原理
以“冠状动脉药物洗脱支架”为例
药物洗脱支架(Drug Eluting Stent,DES)是一种裸支架和药物结合的技术,通过支架上喷涂的特定药物缓慢洗脱,抑制动脉增生组织的生长,同时防止炎症反应的出现,相比于金属裸支架(Bare Metal Stent, BMS) , DES能够提高血管靶向部位的药物浓度,从而显著预防支架植入后的血管再狭窄。DES主要由四个部分组成:涂覆药物涂层的支架平台、药物、聚合物载体以及输送器。传统的支架平台使用的是金属基材,如不锈钢和钴基合金等,这些金属可能引发过敏反应,导致内膜增生,因此在支架表面涂覆生物相容性较好的聚合物载体,可以显著地降低过敏反应,且聚合物载体同时充当药物载体,可以防止药物快速洗脱,实现稳定释药。目前,常用的药物包括紫杉醇、雷帕霉素及其衍生物。
对于组合产品,需要充分分析和论证采用药品和器械进行组合的合理性和必要性,有必要研究其立题依据和主要作用方式是以药物部分还是器械部分的作用为主。
以“以医疗器械作用为主的药械组合产品”为例,组合产品应考虑开展如下研究:
通过化学、物理或其他方式等制造药械组合医疗器械产品时,宜在设计开发全过程中考虑医疗器械和药物间的潜在相互作用,如器械/药物性能间的相互增强或削弱。
需提供药械组合医疗器械中药物的含量/剂量选择/确定依据,如需控制药物释放的,还需提供配方信息如比例以及配方筛选依据。
需对药物潜在引入的化学、物理性能风险进行研究/评估。
药械组合医疗器械,参考GB/T16886系列标准对终产品开展生物学评价,必要时开展生物学试验,宜考虑药物成分与试验系统的兼容性。药物可能会影响生物学试验的结果,应结合药物的作用方式、临床风险/受益论证药物引入的生物学风险是否可接受。
一般在医疗器械动物试验中进行合并评价,并可设定药物相关的观察指标,宜可观察到药械组合医疗器械中药物的有效性,但并不是药效学研究。适当时,宜对药械组合医疗器械中药物的体内外药物释放动力学和体内的药代动力学开展研究。宜特别关注局部组织浓度变化情况、评估最高药物暴露剂量水平下的药代动力学,和考虑耐药性对产品有效性及公众健康的影响。
含有药物的器械与不含药物的器械在原材料、生产工艺、产品性能等方面存在较大差异,二者属于不同的注册单元。
以医疗器械作用为主的药械组合产品,按照第三类医疗器械管理。
分类编码可参考分类目录,在《医疗器械分类目录》中,按照医疗器械管理的药械组合产品,除列出管理类别外,另标注了“药械组合产品”,如03-13-03 含药中心静脉导管、03-13-06带药球囊扩张导管、06-16-04胃镜胶、胃镜润滑液、内窥镜润滑剂、13-05-01含药丙烯酸树脂骨水泥、13-07-02药物洗脱冠状动脉支架、药物洗脱外周动脉支架、13-10-05含蛋白质-2(rhBMP-2) 的骨修复材料、含蛋白质-2(rhBMP-2)的胶原基骨修复材料等。
参考《推荐路径》,药物洗脱冠状动脉支架、整形用注射填充物等产品推荐路径为临床试验,含药中心静脉导管推荐路径为同品种,结合具体产品对其临床评价路径进行判断。
在进行临床评价前,需明确并充分考虑组合产品的临床作用机理、预期用途、可能带来的风险、可能出现的不良事件等。
可参考《医疗器械临床试验质量管理规范》《医疗器械临床评价技术指导原则》《医疗器械等同性论证技术指导原则》《决策是否开展医疗器械临床试验技术指导原则》等相关要求开展组合产品的临床评价。建议申请人结合组合产品的风险和受益,选择合理的临床评价路径,论证其临床应用的安全有效性。
组合产品的临床试验设计常涉及的主要问题包括样本量、统计方法、临床终点、适用范围/功效宣称、以及临床研究数量(若包含多个试验)等。在确定样本量、统计方法、观察指标、临床终点、评估药物-器械的相互作用时,建议结合组合产品的性能特点,论证组合产品临床研究方案设计的科学性和充分性。
(1)冠状动脉药物洗脱支架产品的临床试验分为可行性试验和确证性试验。
① 可行性试验-临床试验方案的设计应以保证受试者的安全为目的,强调以科学的严谨性为原则。可行性试验应有清晰和明确的研究目标。申办者在设计临床试验方案前应对是否需进行可行性试验做充分论证。
② 经过可行性试验研究后,安全性和可行性得到初步证实的产品可继续进行确证性试验,以进一步证实其安全性和有效性。确证性试验是一种事先提出假设并对其进行检验的随机对照试验,应采用前瞻性的多中心试验。
(2)冠状动脉药物洗脱支架的临床试验评价指标一般包括手术成功指标、术后安全性指标、术后有效性指标及同时反映术后安全性和有效性的复合指标。
(3)目前,建议冠状动脉药物洗脱支架确证性试验由两个临床试验组成,其中一个临床试验为随机对照试验,另一个临床试验为单组目标值试验。其中随机对照试验为与对照产品进行的以晚期管腔丢失(Late Loss)为主要研究终点的1:1的不少于200对的试验;单组目标值试验以靶病变失败率(TLF)为主要研究终点,样本量应不少于800例,其中部分病例可来源于随机对照试验的试验组。试验总样本量应在具有统计学意义基础上不少于1000例。两个临床试验的研究假设均需成立。
(4)冠状动脉药物洗脱支架的临床试验持续时间应以植入物的主要研究终点事件达到稳态的时间为依据。冠状动脉药物洗脱支架产品的临床试验随访时间一般为五年,注册申报时应提供至少9个月的临床影像学观察数据和至少12个月的临床随访数据。产品获准上市后,申请人应继续完成全部临床试验。
(5)其他:如冠状动脉药物洗脱支架中所含药物未有中国大陆人群的临床应用史,申请人应提供所含药物在中国大陆人群中的安全性和有效性研究资料和药代动力学研究资料。
添加药物后,相应器械的管理类别和属性可能发生改变,如作为第二类医疗器械管理的产品,添加药物后,成为以医疗器械作用为主的药械组合产品,按第三类医疗器械申报。值得关注的是,亦有医疗器械添加药物后产品的主要作用方式发生改变,导致产品属性发生变化而不作为医疗器械管理的,如液体敷料、凝胶敷料、鼻腔喷雾等产品。
在医疗器械中添加药物成分是把双刃剑,带来收益的同时也存在风险。应提交充分的研究资料证明添加药物的收益是否大于风险。比如,耐药性是一个日益严重的临床问题,任何抗菌剂的使用均可能导致微生物对其的耐药性,因此,在医疗器械中的添加使用抗菌剂,首先应论证产品的立题依据是否合理,不鼓励在器械上盲目添加抗菌成分。
在医疗器械中添加药物,应考虑组合后产品的新增风险,包括但不限于:
①添加药物后,产品的生产工艺(包括灭菌、病毒灭活等)、贮存、运输等是否发生变化及其对产品的影响。
②产品的适用范围、注意事项、禁忌征等是否发生改变。
③药物的配方比例及用量、稳定性、给药途径、释放量和释放型式、药效、活性、体内过程及代谢产物、安全阈值等与其单独使用时是否发生变化及带来的影响。
④药物含量确定的依据,是否能发挥作用,随器械的使用是否突破人体自身的血药屏障,是否产生局部和系统毒性,连续使用的累积效应、使用时限,是否导致耐药等。
⑤考虑器械对药物的影响,如器械对药物的黏附/ 吸收是否会影响其实际剂量,器械原材料的可沥滤物/ 浸提物、器械的降解物或生产过程残留物、器械的激发等是否影
响药物,是否影响终产品的安全性。
⑥考虑药物对器械的影响,如明确器械所用的材料及其添加剂、加工助剂等,明确产品中涂覆或与药物组合的材料及与患者接触的材料,分析添加药物对器械及其性能等造成影响,包括材料或表面变化,器械的完整性、稳定性和耐久性变化等。
⑦证明产品安全、有效所需的其他资料。
(4)含药器械需要关注药物带来的影响,所以应考虑(包括并不只限于)以下这些内容:
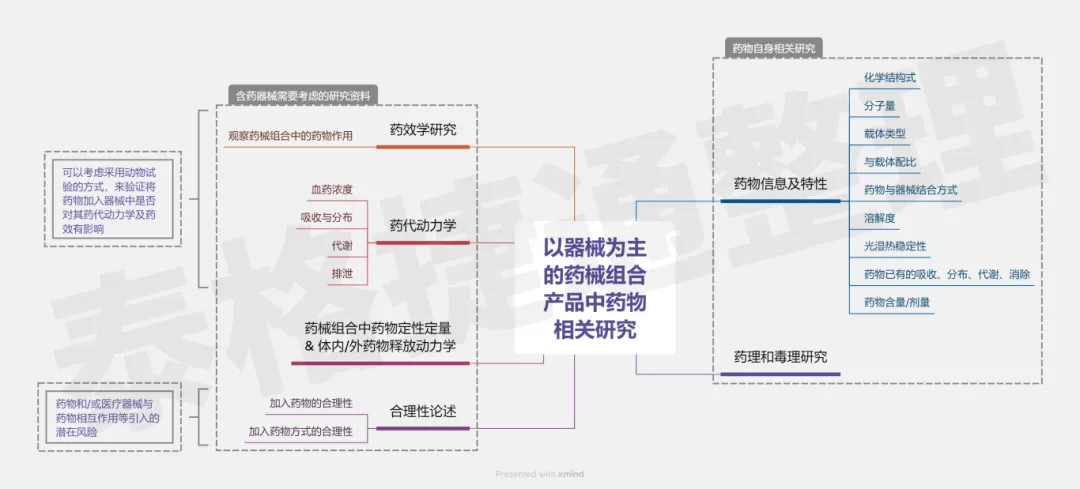
① 未考虑含药医疗器械中药品部分资料的充分性;
② 未充分考虑含药医疗器械的立题合理性;
③ 未充分考虑含药医疗器械中不同组成部分的相互影响;
④ 未充分考虑含药医疗器械的新增风险;
⑤ 未充分考虑含药医疗器械中药物含量确定的依据
《国家药监局关于药械组合产品注册有关事宜的通告》(2021年第52号)
《关于药械组合产品注册有关事宜的通告》(2021年第52号)解读
《以医疗器械作用为主的药械组合产品注册审查指导原则》(2022年第3号)
《以医疗器械作用为主的药械组合产品中药物定性定量及体外释放研究注册审查指导原则》(2022年第3号)
《含药医疗器械产品注册申报资料撰写指导原则》
关于发布《医疗器械分类目录》子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号)
关于发布《医疗器械分类目录》子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号)
关于发布《医疗器械分类目录》子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号)
国家药监局器审中心关于发布医疗器械分类目录相关产品临床评价推荐路径(2024年增补)的通告(2024年第11号)
从药物和器械复合方式的角度来看,含药医疗器械主要分为以下两种类型:
① 药物作为器械的涂层:如药物涂层的体外循环管路、静脉导管、导尿管、补片、医用手套等;
② 药物作为器械的材料组成成分:如药物浸渍的静脉导管、脑脊液分流管路、含有药物的骨科/口腔科充填材料、敷料、体外生殖产品、医用缝合线等"。
由于药械组合产品的形式多样、不同国家或地区对组合产品的定义和监管模式不同、以及部分产品本身的主要作用方式尚不明确或存在争议等原因,仍存在申请人无法确定产品管理属性的情形,对于这种情况,申请人应当在申报注册前向标管中心申请药械组合产品属性界定。
目前,已有不同类型的药械组合医疗器械产品获批上市,例如,生物可吸收雷帕霉素洗脱冠脉支架系统、含利多卡因注射用交联透明质酸钠凝胶、含利多卡因胶原蛋白植入剂、庆大霉素骨水泥、紫杉醇药物涂层外周球囊扩张导管等。