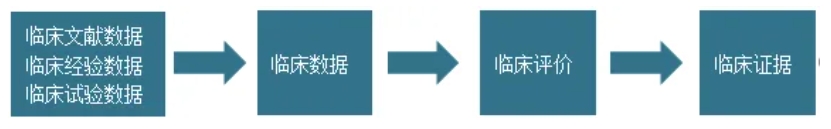
“临床试验”(Clinical Investigation)是为评价医疗器械的安全性、临床性能和/或有效性,在一例或多例受试者中开展的系统性的试验或研究。临床试验是获取“临床数据”(Clinical Data)的一种方式。
“临床数据”(Clinical Data)是医疗器械临床使用过程中产生的安全性、临床性能和/或有效性信息。临床数据可以来源于多个方面,可以是申报产品或同品种医疗器械上市前和上市后的临床试验或文献数据,也可以是登记研究、不良事件数据库、病历数据等临床经验数据。
“临床评价”(Clinical Evaluation)是由注册申请人采用科学合理的方法,对临床数据进行的分析评价,用于论证产品对安全和性能基本原则的符合性。临床评价后形成的报告及相关数据作为“临床证据”(Clinical Evidence)纳入技术文档中。
“临床证据”(Clinical Evidence)是医疗器械技术文档的重要组成部分,注册申请人可根据现行法规的要求,提交临床证据以供监管部门审评。它们之间的关系如下图所示:
定义:为评价医疗器械的安全性、临床性能和/或有效性,在一例或多例受试者中开展的系统性的试验或研究。 解释:临床试验包括可行性试验、为获得上市批准而进行的试验,以及在上市批准后开展的试验。 定义:在医疗器械临床使用过程中产生的安全性、临床性能和/或有效性信息。 解释:临床数据的来源包括: 1.申报产品上市前和上市后临床试验数据; 2.同品种医疗器械上市前和上市后的临床试验数据; 3.已发表和/或未发表的申报产品或同品种医疗器械的临床 经验数据; 4.其他来源的临床经验数据,如登记研究、不良事件数据库和病历数据等。 定义:采用科学合理的方法对临床数据进行分析评价,以确认医疗器械在其适用范围下的安全性、临床性能和/或有效性的持续进行的活动。 解释:临床评价由注册申请人实施,用于论证产品对安全和性能基本原则的符合性。临床评价的结果是临床评价报告,可提供给监管部门进行审评。临床评价报告对临床数据及其质量进行详细阐述,论证临床数据如何证明产品对安全和性能基本原则的符合性。临床评价需持续开展,产品上市后,注册申请人需对产品安全性、临床性能和/或有效性信息进行常规监测,并根据更新的信息,进行风险受益再评估。 临床评价的输入主要是来源于临床试验报告、临床文献和临床经验的临床数据。根据产品特征、适用范围、注册申请人宣称、警示及注意事项的充分性、临床使用经验的不同,论证产品对安全和性能基本原则符合性需要的临床数据和证据亦不相同。临床评价旨在证明,与患者受益相比,产品使用相关的风险可接受,且能较高程度地保护患者健康及安全。因此临床评价需与风险管理文件相互参照。 定义:与医疗器械相关的临床数据及其评价。 解释:临床证据是医疗器械技术文档的重要组成部分,与其他设计验证及确认文件、产品描述、说明书和标签、风险分析及生产信息共同论证产品对安全和性能基本原则的符合性。通过与技术文档相关内容相互参照,以对其进行合理解释。 注册申请人可根据现行法规的要求,提交临床证据以供监管部门审评。临床证据可用于支持产品上市,包括产品的适用范围以及对于产品安全性、临床性能和/或有效性的宣称。图1 显示临床证据的需求如何推动数据生成以及临床评价的过程。 产品上市后,申报产品和/或同品种器械在临床实际使用中将产生新的安全性、临床性能和/或有效性信息,注册申请人需在产品全生命周期中进行周期性审核并更新临床证据。