

一、稽查背景
申办者应建立对临床试验的质量控制和质量保证系统,可组织对临床试验的稽查以保证质量。药品/器械监督管理部门、申办者可委托稽查人员对临床试验相关活动和文件进行系统性检查,以评价试验是否按照试验方案、标准操作规程以及相关法规要求进行,试验数据是否及时、真实、准确、完整地记录。稽查应由不直接涉及该临床试验的人员执行。
指由不直接涉及试验的人员所进行的一种系统性检查,以判定试验的实施、数据的记录和分析是否与试验方案、药品/医疗器械临床试验管理规范与法规要求相持。
由自身组织或机构的内部稽查员对自身公司内部的临床研究行为规范是否符合内部要求的质量和结构标准而进行评价
由客户对签约组织进行临床质量行为的评价,以确保合同研究组织或服务商满足合同所规定的行为规范,其中包括SOP和药监标准的执行。简单地说,这是一种第一方(如申办者等)对第二方(如合同研究组织等)进行稽查的形式
由外部的稽查员或特邀的第三方稽查员来完成稽查行为。其目的是为了对临床试验质量和依从性有更加独立和客观的评价
稽查临床试验所用的系统、 程序或过程是否满足药监当局、法律和公司的政策、规范和指南。这类稽查通常是有计划性地针对某一研究活动而开展。
评价临床试验过程中遵循已建立的标准程序和计划设定目标的能力,或评价合同研究组织或研究机构是否有能力和资格承担某项试验项目,或者他们拥有的运营、程序和质控系统是否符合申办者或药政要求。
由于某种问题或事故的出现,或不良GCP行为被举报,需要对相关公司、医院或个人的临床试验过程的行为或环境进行稽查,以便确认问题或事故的原因及其相应结论的落实。有时这种稽查可能变成飞行突击监查,也被称为意外监查。
确认对过去稽查活动中所发现问题的解决程度和相应的矫正行动的进展情形。
向个人或单位提供稽查程序培训, 通常是为了使相关单位对计划中的药监视察要求和程序有所了解,以便做好被视察的准备。
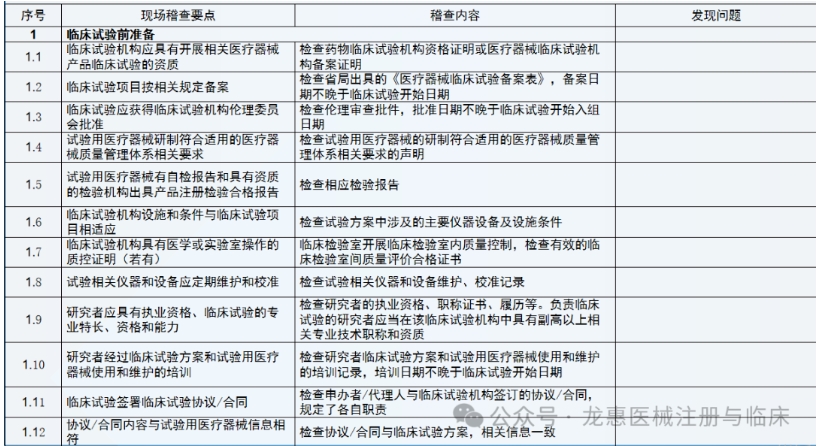
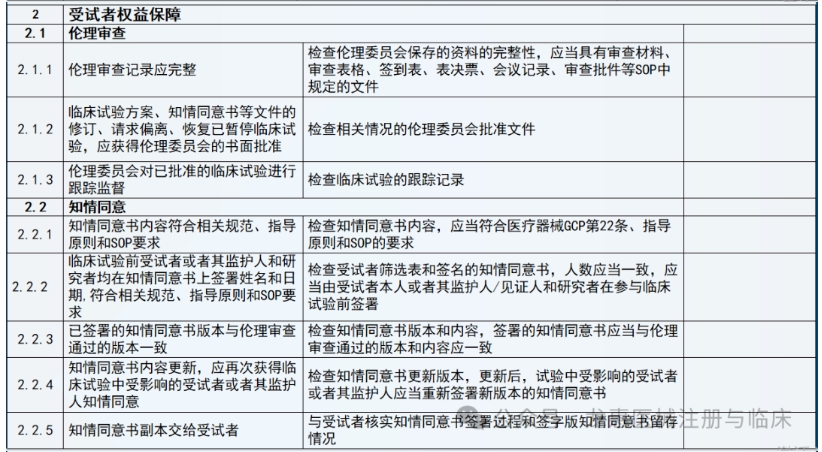
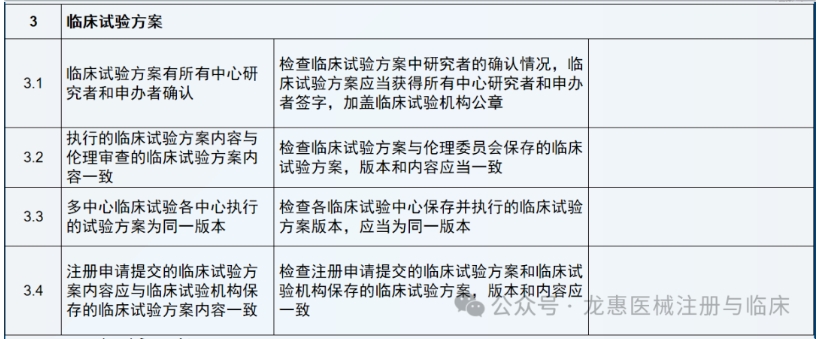
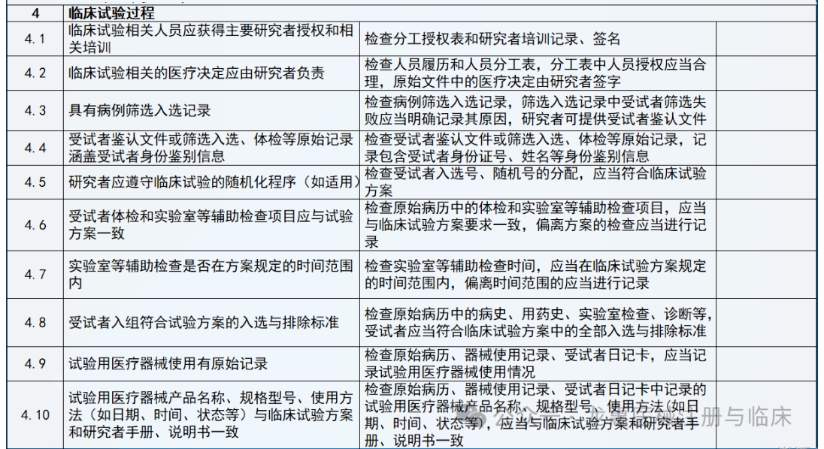
通常是依据稽查计划书来开展,稽查计划书通常需要包括的内容有稽查的目的、待稽查的材料和设备,或环境的目标、稽查使用的工具或手段、稽查的时间、稽查团队成员、稽查结果的报告形式和对象、稽查发现问题后的对策等。任何稽查过程都需要有资质的人员来完成。
(1)企业委托第三方稽查公司,签订稽查协议。
(2)第三方稽查公司接收临床试验项目相关资料,包括但不限于临床试验方案、 ICF、CRF、原始记录等相关文件。
(3)企业和第三方稽查公司共同确定被稽查的临床试验机构和稽查时间。
(4)第三方稽查公司组建稽查团队,制订稽查方案、稽查记录表格等。
(5)企业向被稽查的机构提出稽查申请,发出稽查函,获得机构批准。
(6)第三方稽查公司在临床试验机构召开稽查启动会,向临床试验机构的有关人员介绍本次稽查的目的、内容和程序,并请主要研究者介绍临床试验的有关情况。
(7)请求研究者的协助,请其向相关辅助科室发出稽查通知,获得辅助科室的配合。
(8)派遣稽查人员进驻临床试验机构进行现场稽查,对研究者文件夹、知情同意书、原始文件/病例报告表、机构HIS、LIS系统等进行稽查。
(9)根据发现的问题提出建议并分别与研究者、机构老师确认并沟通解决办法。
(10)整理稽查记录及问题,完成稽查报告。
(11)与申办方沟通,完成整改报告。
方案
知情同意书
病历报告表
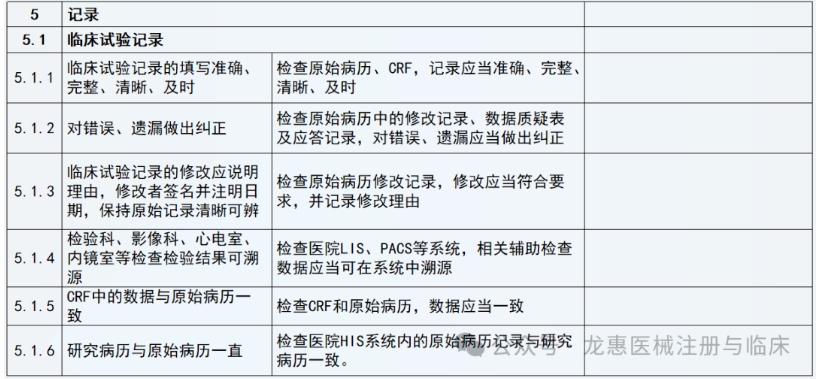
研究病历
试验SOP
试验用相关表格
设盲SOP
ICF、CRF、研究病历等(已填写文件)
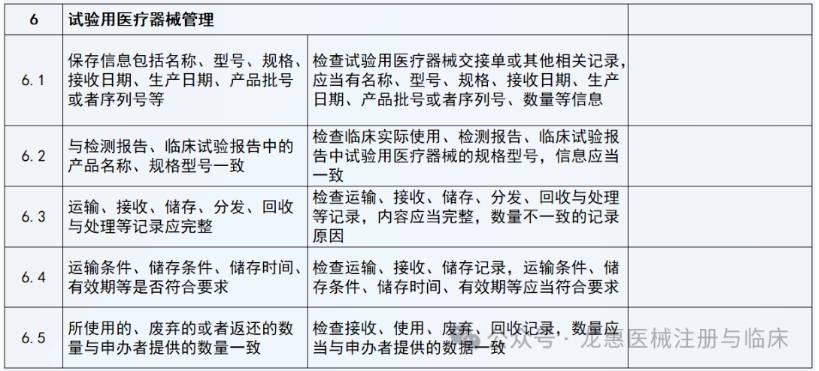
根据稽查发现的问题,稽查结果按以下原则判定:
(一)有以下情形之一的,判定为存在真实性问题:
1.编造受试者信息、主要试验过程记录、研究数据、检测数据等临床试验数据,影响医疗器械安全性、有效性评价结果的;
2.临床试验数据,如入选排除标准、主要疗效指标、重要的安全性指标等不能溯源的;
3.试验用医疗器械不真实,如以对照用医疗器械替代试验用医疗器械、以试验用医疗器械替代对照用医疗器械,以及以其他方式使用虚假试验用医疗器械的;
4.瞒报与临床试验用医疗器械相关的严重不良事件和可能导致严重不良事件的医疗器械缺陷、使用方案禁用的合并用药或医疗器械的;
5.注册申请的临床试验报告中数据与临床试验机构保存的临床试验报告中的数据不一致,影响医疗器械安全性、有效性评价结果的;
6.注册申请的临床试验统计分析报告中数据与临床试验统计数据库中数据或分中心临床试验小结中数据不一致,影响医疗器械安全性、有效性评价结果的;
7.其他故意破坏医疗器械临床试验数据真实性的情形。
(二)未发现真实性问题的,但临床试验过程不符合医疗器械临床试验相关规定要求的,判定为存在合规性问题。
(三)未发现上述问题的,判定为符合要求。
