

作为上市后监管的核心工具,定期风险评价报告是企业落实全生命周期管理的关键抓手。通过系统整合不良事件报告、用户反馈等数据,企业可精准识别潜在风险信号,推动产品持续优化。然而,很多企业在撰写时容易陷入对法规理解不深入、报告格式不规范、数据收集不全面等误区,影响报告质量和审核通过率。那么本期文章就跟大家分享一下定期风险评价报告撰写的一些相关细则:
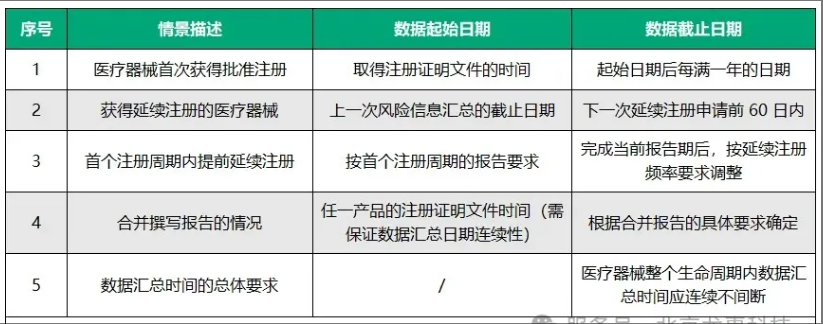
数据汇总时间要求

产品风险评价报告应当采用中文撰写,包含封面、目录、正文、附件等部分。
封面包括产品名称、注册证/备案证批准日期、报告类别(首次注册/延续注册)、报告次数、报告期、本期国内销量、本期境外销量、本期不良事件报告数量,企业名称、联系地址、邮编、传真,负责产品安全的的部门、负责人及联系方式(包括手机、固定电话、电子邮箱等),报告提交时间,以及隐私保护等相关信息。
目录应当尽可能详细,一般包含三级目录。
《定期风险评价报告》正文的主要内容包括:产品基本信息、国内外上市情况、不良事件报告信息、监测数据和文献资料分析情况、产品检验结果、既往风险控制措施、产品风险分析、本期结论、附件、其他风险信息等。
产品基本信息:本部分信息主要包括:医疗器械名称、型号和/或者规格、注册证编号、结构及组成、主要组成成分、适用范围(预期用途)、有效期等。
国内外上市情况:
1.获得上市许可的主要国家和地区、批准注册/备案时间、注册/备案状态等,一般采用表格形式汇总。
2.产品批准上市时提出的有关要求,特别是与风险控制有关的要求;
3.批准的适用范围(预期用途)以及特殊人群情况,如该产品在我国的适用范围(预期用途)与其他国家或者地区存在差异,应当给予说明。
监测数据和文献资料分析情况:应当详细分析境内外不良事件监测数据、与安全性相关的文献,以及产品说明书或操作手册中与本次关注风险相关的内容等。
产品检验结果:如果产品进行了复检,应当明确是否符合经注册或者备案的产品技术要求。如果未进行产品复检,说明未开展该项工作即可。
撤销医疗器械批准证明文件;
停止生产、销售相关产品;
通知医疗器械经营企业、使用单位暂停销售和使用;
实施产品召回;
对生产质量管理体系进行自查,并对相关问题进行整改;
修改说明书、标签、操作手册等;
改进生产工艺、设计、产品技术要求等;
开展医疗器械再评价;
按规定进行变更注册或者备案;
其他风险控制措施;
产品风险分析:应当从设计开发、生产管理、流通与储存、操作使用、维修保养、售后服务等方面分析综合产品风险情况,重点分析不良事件发生的主要原因,不良事件的特点是否发生改变、不良事件的报告频率是否增加、不良事件的特点和频率变化对产品总体安全性的影响。
其他风险信息:介绍与产品风险相关的文献资料研究、产品风险评价、重点监测、再评价等情况。
如果在数据截止日期后、报告提交前,发生因产品风险原因而采取措施的情况,也应在此部分介绍。
