


稽查内容
1)协议;
2)财务状态;
3)临床试验方案和修订管理;
4)临床试验机构对临床试验方案和监管要求的偏离相关管理;
5)临床试验机构、申办者、合同供应商或第三方严重或持续违反临床试验方案或监管要求的管理;
6)监查员选择标准(如适用);
7)监查程序;
8)试验用器械管理;
9)器械缺陷(如适用);
10)安全性评价和不良事件报告;
11)病例报告表设计、数据输入和校正过程;
12)数据处理、数据分析的控制(如适用);
13)临床试验报告(如适用);
14)文件管理;
15)临床试验职责和职能外包(如适用);
16)进行临床试验的计算机化系统(如适用)。

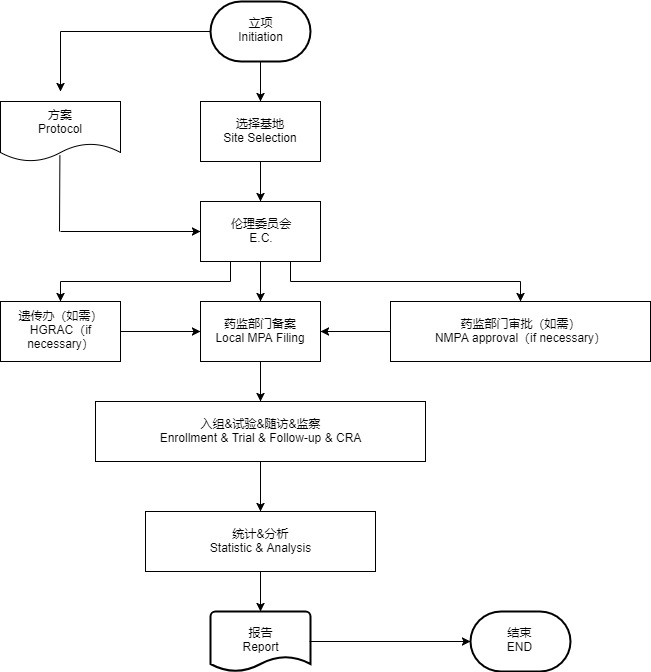
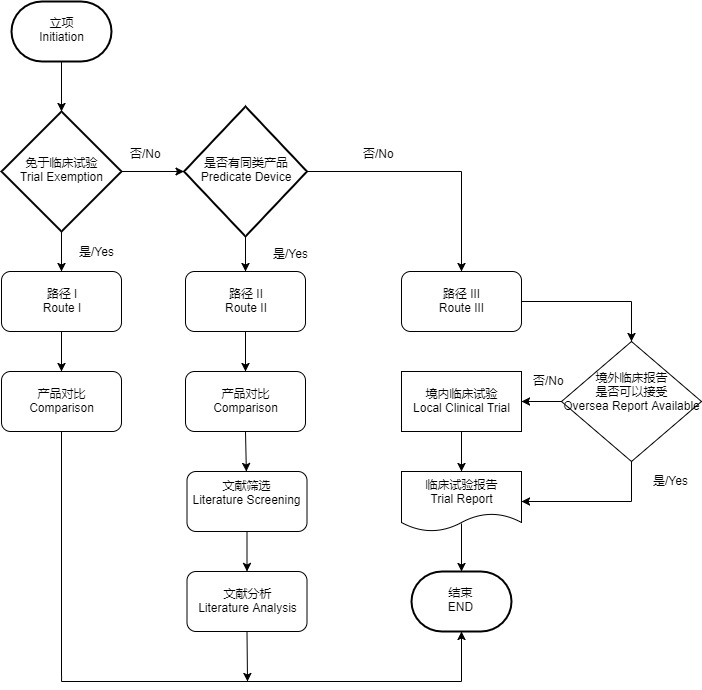
临床前研究--动物实验流程
1.选择具有科研能力的GCP试验基地;
2.制定动物试验的试验方案:
3.试验结论的分析和汇总;
4.试验报告的总结完成。
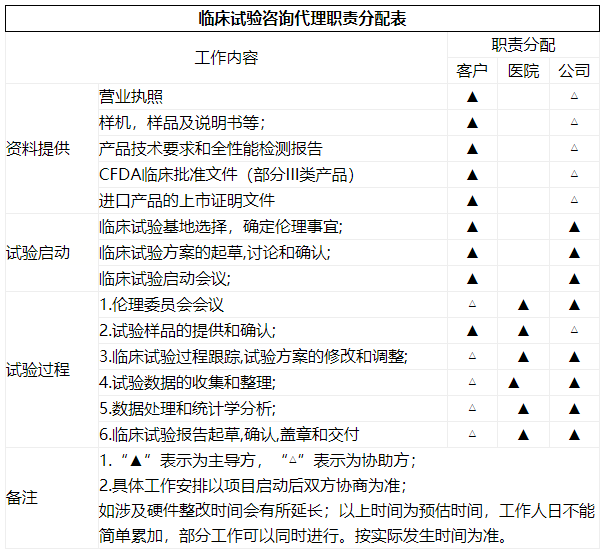
1.临床试验基地选择,确定伦理事宜;
2.临床试验方案的起草,讨论和确认;
3.临床试验启动会议;
4.伦理资料的准备以及试验项目的讲解;
5.试验样品的提供和确认;
6.临床试验过程跟踪,试验方案的修改和调整;
7.试验数据的收集和整理;
8.数据处理和统计学分析;
9.临床试验报告起草,确认,盖章和交付.
