2月17日,国家药监局、国家卫健委、国家医保局发布《关于做好第三批实施医疗器械唯一标识工作的公告》,提出开展第三批医疗器械唯一标识工作。 《公告》指出,按照风险程度和监管需要,确定部分临床需求量较大的一次性使用产品、集中带量采购中选产品、医疗美容相关产品等部分第二类医疗器械作为第三批医疗器械唯一标识实施品种。
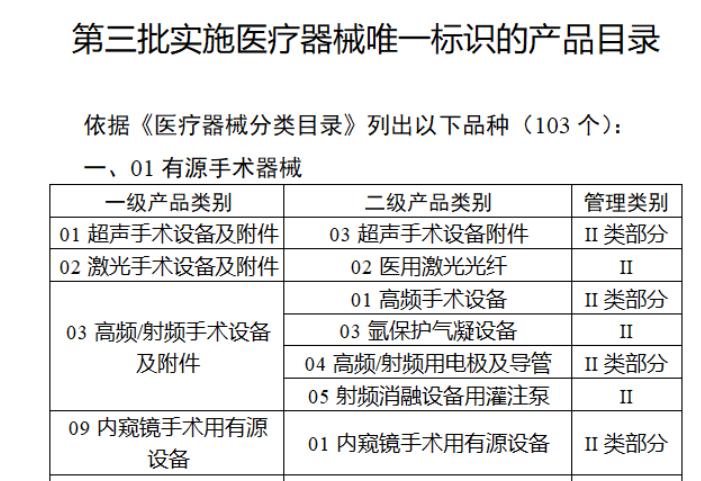
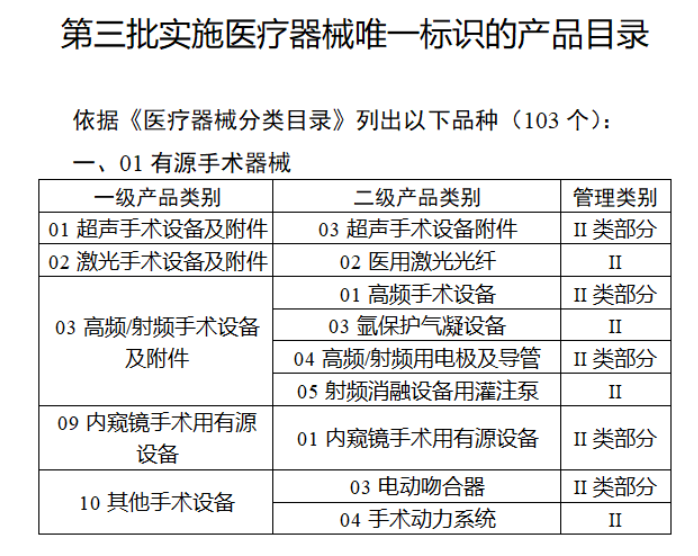
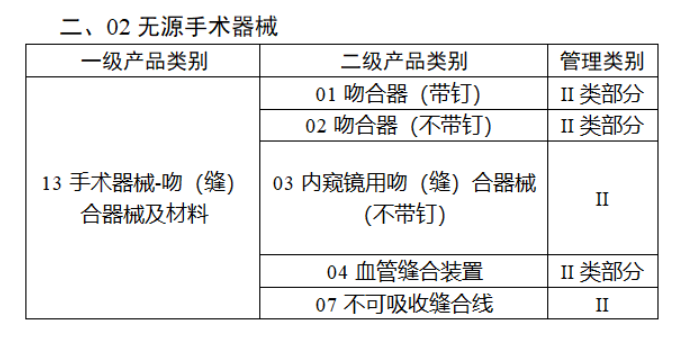
共有103种医疗器械被纳入此次唯一标识实施工作中,包括超声手术设备、激光手术设备及附件、高频/射频手术设备及附件、内窥镜手术用有源设备、神经和心血管手术器械-心血管介入器械、骨科手术器械、诊断X射线机、光治疗设备、起搏系统分析设备、注射泵、临床检验器械等。
根据《公告》,对列入第三批实施产品目录的医疗器械,注册人应当按照时限要求有序开展以下工作:
2024年6月1日起生产的医疗器械应当具有医疗器械唯一标识;此前已生产的第三批实施唯一标识的产品可不具有唯一标识。生产日期以医疗器械标签为准。
2024年6月1日起申请注册的,注册申请人应当在注册管理系统中提交其产品最小销售单元的产品标识;2024年6月1日前已受理或者获准注册的,注册人应当在产品延续注册或者变更注册时,在注册管理系统中提交其产品最小销售单元的产品标识。
产品标识不属于注册审查事项,产品标识的单独变化不属于注册变更范畴。
2024年6月1日起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库,确保数据真实、准确、完整、可追溯。
对于已在国家医保局医保医用耗材分类与代码数据库中维护信息的医疗器械,要在唯一标识数据库中补充完善医保医用耗材分类与代码字段,同时在医保医用耗材分类与代码数据库维护中完善医疗器械唯一标识相关信息,并确认与医疗器械唯一标识数据库数据的一致性。
当医疗器械最小销售单元产品标识相关数据发生变化时,注册人应当在产品上市销售前,在医疗器械唯一标识数据库中进行变更,实现数据更新。医疗器械最小销售单元产品标识变化时,应当按照新增产品标识在医疗器械唯一标识数据库上传数据。
二、“身份证”捆绑:全周期可追溯
在医疗器械领域,以往流通使用环节无码或者一物多码现象普遍,给监管带来阻力。 医疗器械唯一标识(Unique Device Identification,简称UDI)相当于是医疗器械的身份证,由产品标识和生产标识组成,产品标识是识别注册人/备案人、医疗器械型号规格和包装的唯一代码;生产标识包括与生产过程相关的信息,包括产品批号、序列号、生产日期和失效日期等,可与产品标识联合使用。 全球范围内,UDI都是医疗器械监管领域关注的焦点和热点。据了解,2013年,国际医疗器械监管机构论坛发布医疗器械唯一标识系统指南。同年,美国发布医疗器械唯一标识系统法规,要求利用7年时间全面实施医疗器械唯一标识。2017年,欧盟立法要求实施医疗器械唯一标识,日本、澳大利亚、阿根廷等国家也相继开展相关工作。 国家医保局此前指出,从政府管理角度,医疗器械监管部门利用UDI,可构建医疗器械监管大数据,实现医疗器械监管来源可查、去向可追、责任可究;卫生行政管理部门利用UDI,可提升对医疗用械使用行为的规范管理水平,推动建立健康医疗大数据;医保部门利用UDI,有助于在招标采购中精准识别医疗器械,实现结算透明化,打击欺诈行为。 而从产业发展角度,医疗器械注册人备案人实施UDI,有助于提升企业信息化管理水平,建立产品追溯体系,提升企业管理效能;医疗器械经营企业实施UDI,可建立符合现代化的物流体系,实现医疗器械供应链的透明化、可视化、智能化;医疗机构实施UDI,可实现院内耗材精准管理,减少用械差错。 2021年1月1日,国内9大类69种第三类医疗器械第一批实施医疗器械唯一标识。2022年6月1日,其他第三类医疗器械(含体外诊断试剂)第二批实施医疗器械唯一标识。 据观察,此前已有海南、福建、四川、北京、天津等省市提前推进第二类医疗器械唯一标识工作,部分企业积极开展二类医疗器械UDI工作。三、多码联动,招采、支付透明化
伴随国家层面UDI新规的出台,接下来全国所有地区将全面推进前述医疗器械的唯一标识工作。 对于医疗器械注册人而言,《公告》谈到,要鼓励基于唯一标识建立健全追溯体系,做好产品召回、追踪追溯等有关工作。对于因《医疗器械分类目录》动态调整导致产品管理类别发生变化的情况,医疗器械注册人应当按照调整后管理类别的要求实施唯一标识。 《公告》还指出,医疗器械经营企业要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。 医疗机构要在临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。 值得关注的是,医疗器械身份证也将与国家医保编码关联使用。 根据《公告》,省级药品监督管理部门要加强唯一标识工作的培训指导,结合实施工作推进需求做好产品注册系统改造,组织辖区内医疗器械注册人按要求开展产品赋码、数据上传和维护工作,加强与辖区内卫生、医保部门协同,推动三医联动。 省级卫生健康部门要指导辖区内医疗机构积极应用唯一标识,加强医疗器械在临床应用中的规范管理。 省级医保部门要加强医保医用耗材分类与代码与医疗器械唯一标识的关联使用,推动目录准入、支付管理、带量招标等的透明化、智能化。 目前,国家医保编码的推进工作已进入最后一公里。两码联动后,医疗器械全链条也将迎来全新监管。
附件:
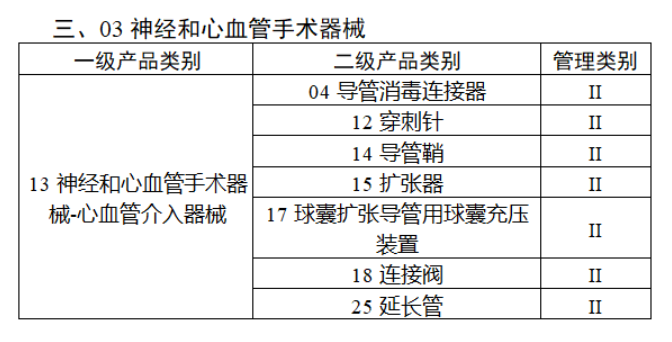
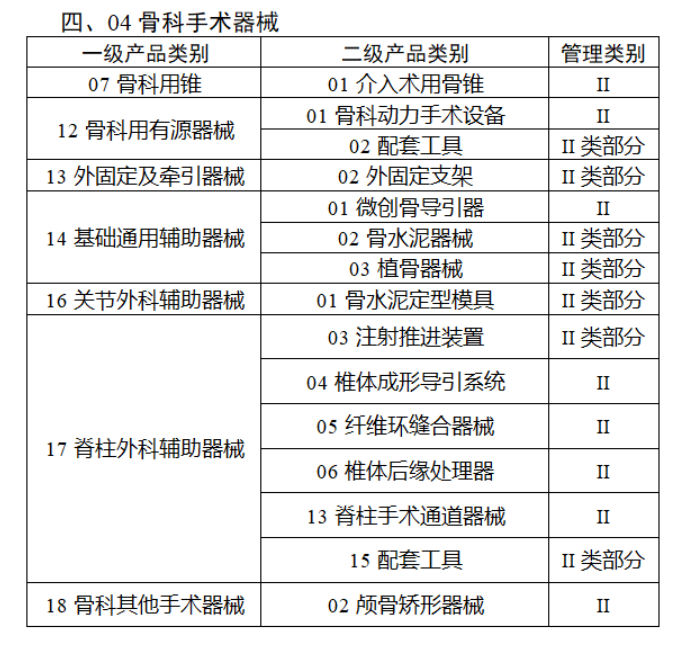
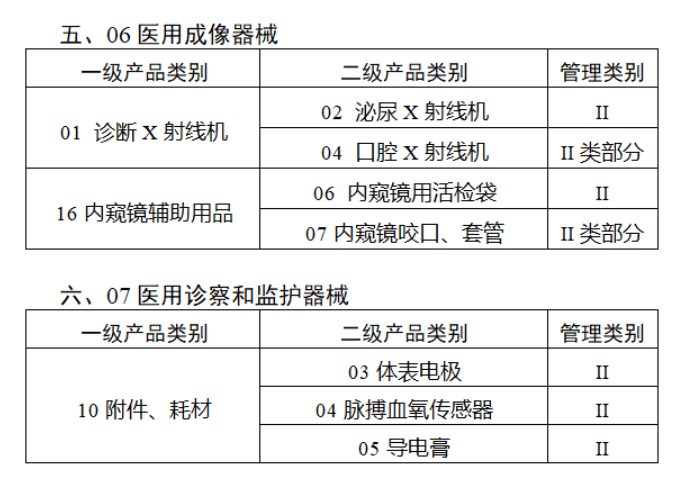
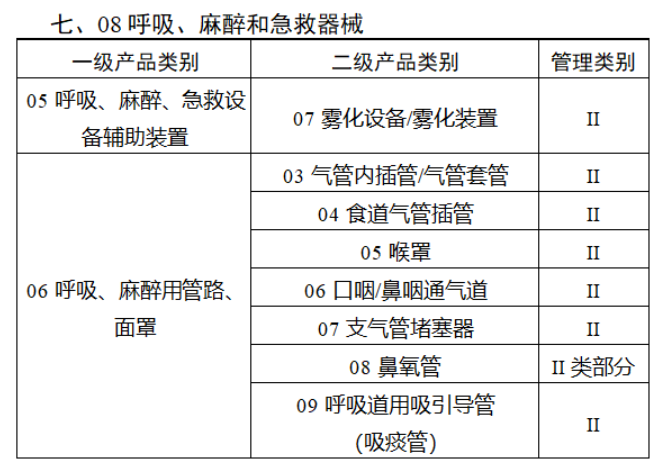
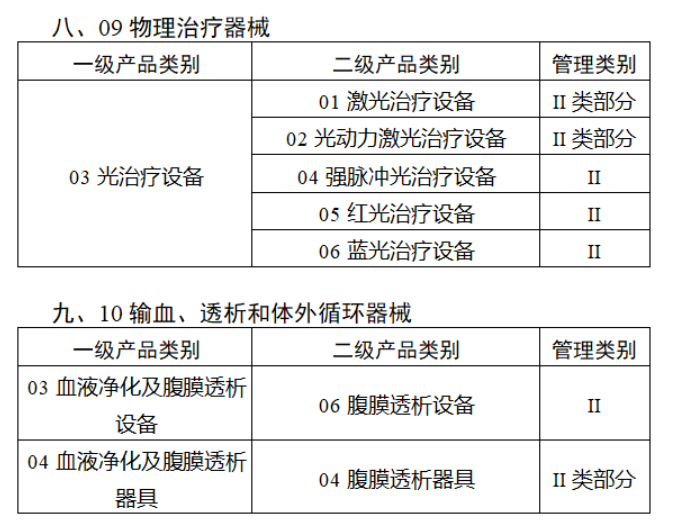
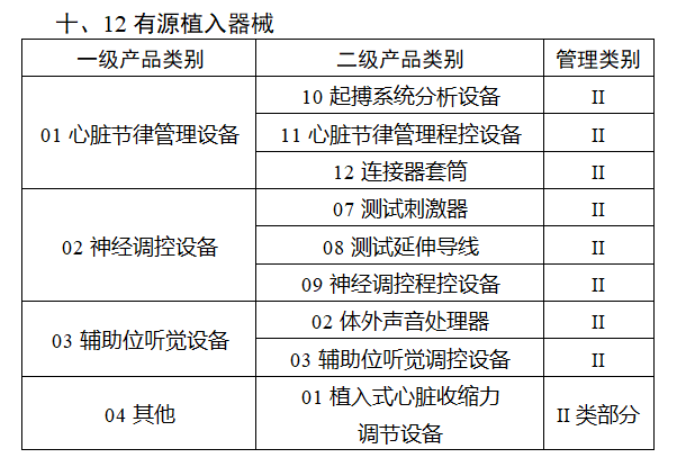
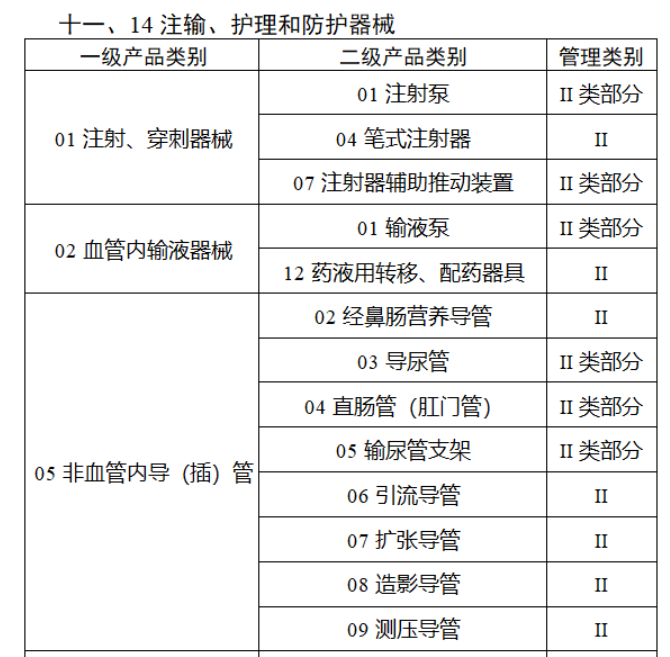
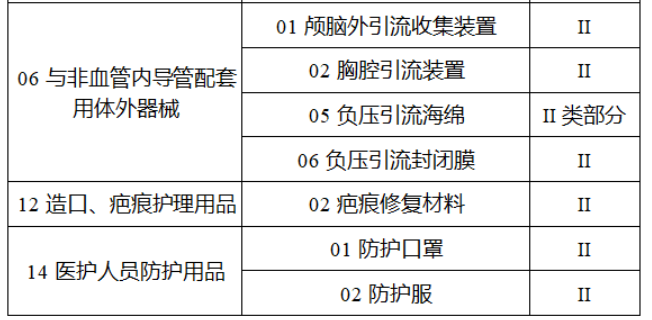
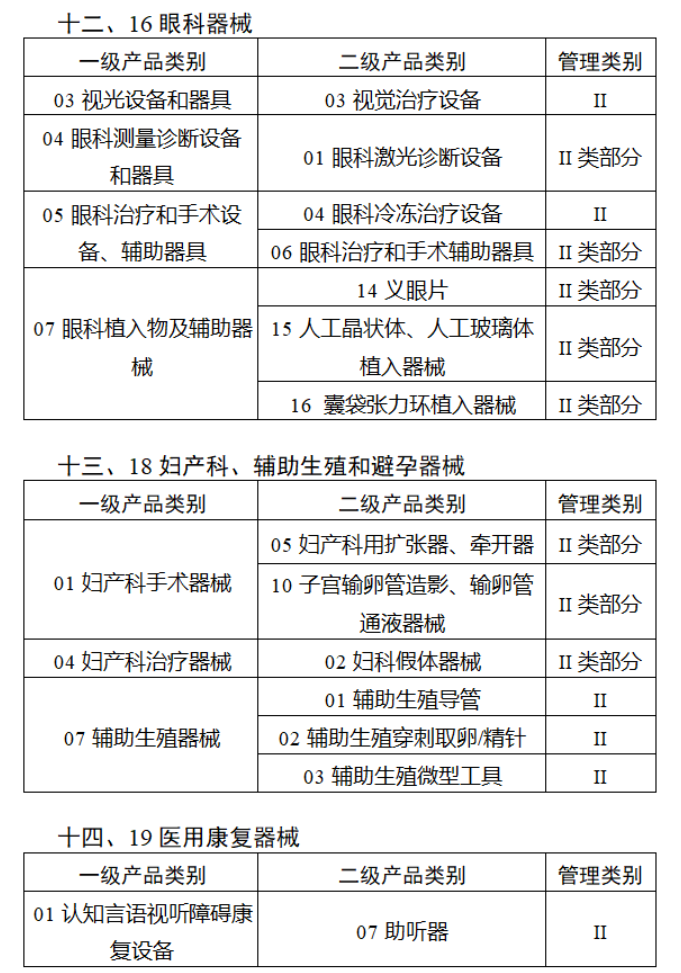
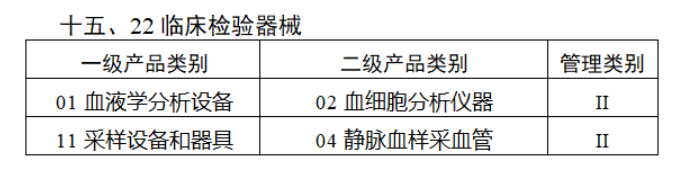
声明:此文版权归原作者所有,文中图片均已获得版权方授权使用。若有来源错误或者侵犯您的合法权益,您可通过网站谈话框与我们取得联系,我们将及时进行处理。