医疗器械临床评价是指采用科学合理的方法对临床数据进行分析、评价,以确认医疗器械在其适用范围内的安全性、有效性的活动。
1.识别相关临床数据;
2.评估各数据集的适宜性和贡献;
3.分析各数据集,得出产品安全性、临床性能和/或有效性以及产品临床使用相关信息方面(如说明书和标签等)相关的结论。
1.豁免临床,列入《免于进行临床评价目录》的产品,若符合,按照免临床途径申报;
2.同品种对比,找对应已有有效注册证书的对比产品进行性能,组成,形态等对比分析。从产品性能的安全、有效性验证两者等同以达到临床评价的目的;
3.临床试验,开展临床试验验证产品性能满足临床预期用途。
按照医疗器械类别来看:
第一类医疗器械:不需提交临床评价资料;
第二类、三类医疗器械:(1)豁免目录路径(2)同品种临床评价报告路径(3)临床试验路径
1.当申报产品与同品种医疗器械不存在差异时,则对同品种医疗器械临床文献和/或临床经验数据进行收集、分析,形成临床评价报告,完成临床评价;
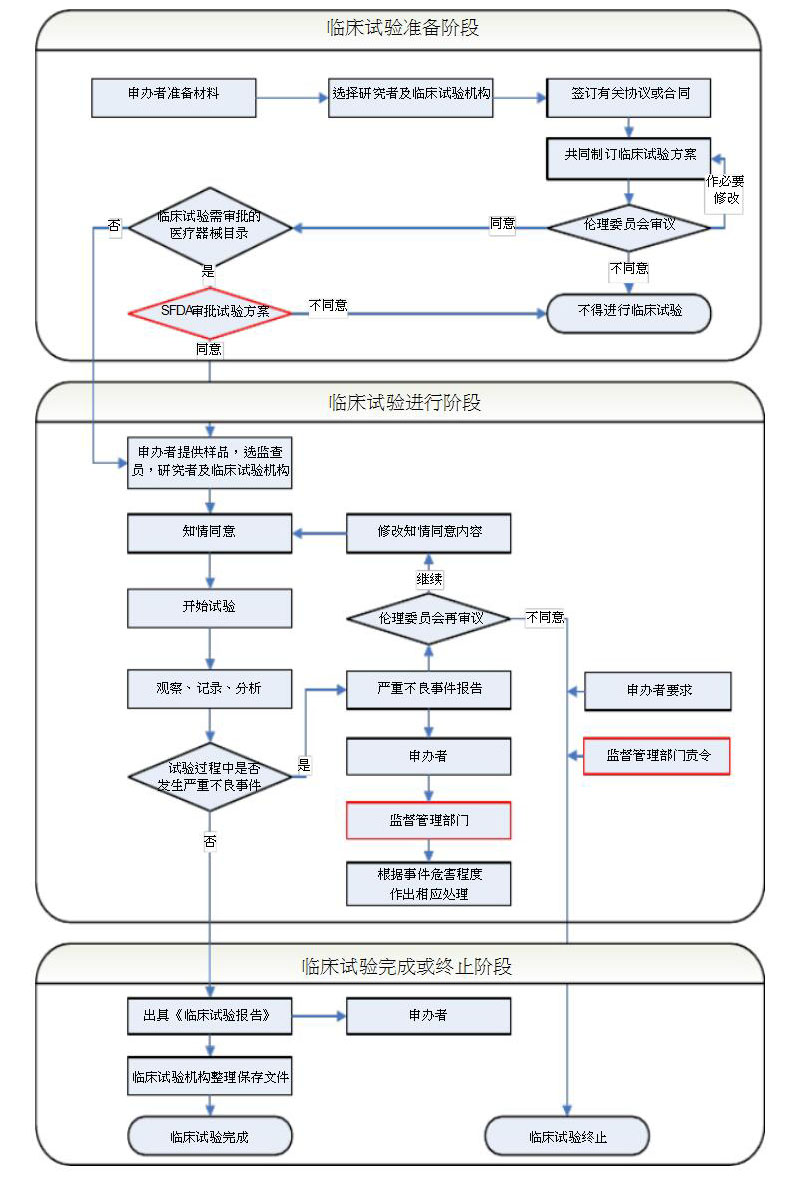
二:医疗器械临床试验
1.准备阶段(试验前):临床试验前的准备工作,和医疗试验机构的对接工作。
2.实施阶段(试验中):患者的入组、临床监查等。
3.结题阶段(试验结束):质控、总结、数据录入分析。下面就一一介绍其流程和要求:
注册检测是临床试验的前提;注册检测阶段可以提前准备临床试验工作(调研CRO时机、提前和机构中心沟通、筛选,如需);做好注册检测与临床试验衔接工作(1年有效期);根据原则判断是否进行动物试验(长期植入的医疗器械)
NMPA数据库上市产品查询;遴选对照品原则,结合产品研制;对照品购买情况;CMDE指导原则
合理安排时间,按照计划执行;进行整体费用统筹,有效的 成本控制:研究费用、对照品费用、会议费用、差旅费用、数据 管理费、统计费、人员费用等
产品注册审查指导或临床试验指导原则;临床试验设计指导原则;产品型号规格;适用范围;对照品选择;
入选和排除标准;随访周期;终点指标;病例数估计筛选机构中心召开方案讨论会;项目立项+过伦理;临床审批(NMPA,如果需要);和机构中心签署合同;省局备案;人类遗传资源管理(如果需要)
筛选合适研究中心,保障项目后期顺 利实施,成功的一半;部门:机构、科室、IEC
确保方案的科学性、伦理性、法规性;所有单位主要参与人员(申办方、 研究者、临床试验机构、统计专家);资料准备充分;会议讨论目的明确;签到和会议纪要;明确会议结论
机构立项和伦理申报:取得注册检测报告;对照品资料;申报顺序;沟通各家机构和伦理资料要求、 时间、频率;资料准备,申办方盖章;立项和伦理资料递交;伦理批件领取;准备其它参与单位立项和伦理申报
需进行临床试验审批的第三类医疗器械合同谈判及签署
省局备案表;营业执照(复印件);伦理批件和合同(复印件);取得CFDA批件(8类产品)
地点:申办方或者境内代理人所在地省局
特点:一家一备
入组:ICF签署;入组前检查;入排标准核实;资料记录方式。随访工作:按照时间窗随访;日记卡填写;实验室报告完整;交通补助发放
入组监查:按照监查计划进行监查;按时提交监查报告,进行问题解决;方案违背上报;安全性AE记录和SAE报告;器械缺陷机构质控和CRO质控同时进行。协同监查:定期监查定期安排文件;发现各中心存在的问题,及时采取相应措施
公司专人进行稽查,发现系统性风险与错误。
受试者随访完成;资料填写完成和整理IF、相关表格、受试者文件夹等资料;监查及问题处理 监查工作完成,相关问题整改完成,伦理上报完成
器械清点回收(视器械情况而定);研究者文件夹与受试者文件夹资料归档
医疗器械临床试验机构进行抽查或者全部检查;数据溯源核实;相关问题进行整改
CRF进行第一联、第二联撕取回收(具体按照方案而定);数据录入员进行数据录入
数据管理员出具query,研究者答疑,再次数据录入;锁库与盲态审核会:数据库锁库,并与相关人员进行数据集划分
统计专家出具统计报告,进行审核后定稿
根据临床试验结果,对临床试验进行总结,撰写总结报告初稿
对试验中问题、结果及总结报告进行讨论
各研究中心研究者签字,机构盖章
总结报告盖章完毕进行机构归档;总结报告移交注册部门
1. 试验方案的制定必须符合伦理道德标准:制定的试验方案必须符合民众伦理和伦理道德的要求,保障患者的权益和安全性。
2. 试验过程的监管必须得到相关机构的批准:试验过程必须遵循相关的行业标准和政策法规,并获得相关机构的批准。
3. 审查报告时,需要充分查证数据的真实性和准确性。