

伴随着人工智能技术的不断发展和在医疗器械行业的深入应用,自2020年起,第一款采用深度学习的人工智能独立软件产品——冠脉血流储备分数计算软件获批上市,为医疗器械这一强监管行业带来了崭新的机遇和未知的挑战。经过四年的沉淀,该领域的临床应用已经涵盖肺、心脏、颅脑、骨骼、消化道、眼底等。
1、人工智能医疗器械的分类
依从医疗器械软件产品的分类,人工智能医疗器械分为人工智能独立软件和含有人工智能软件组件的医疗器械。其中,人工智能独立软件的代表性产品包括:
肺结节CT图像辅助检测软件
糖尿病视网膜病变眼底图像辅助诊断软件
冠脉CT造影图像血管狭窄辅助评估软件
颅内出血CT图像辅助分诊软件
含有人工智能软件组件的代表性产品,如磁共振成像系统(含人工智能软件功能)。
2、人工智能医疗器械的监管挑战
针对人工智能医疗器械这一新兴赛道,监管方面存在多方面的挑战,具体包括算法迭代快、训练数据质量不可控、缺少对口的法规标准、网络安全问题和云计算特殊性等,审评人员对技术的理解和监管方法受主观因素影响较大。
1)、算法迭代问题
数据驱动型算法在经过大量临床数据的输入后,算法通过不断学习和优化,能够自动调节参数和结构以适应新的数据和场景,但算法更新是一个复杂且非线性的过程,可解释性差,目前尚缺少对数据驱动型算法更新的明确要求;
2)、训练数据质量问题
通常企业训练AI可以采用公开数据库的数据,但公开数据库不能用作测试集,企业仍需构建自建数据库,这就考验企业与临床机构的合作关系,在数据采集和专业医师标注过程中倾注了大量的医疗资源。
对数据库的质量把控由企业自身完成,标注的准确性将直接影响到AI模型的训练效果和实际应用性能,这种风险有可能在AI模型投入临床应用后才逐渐显现,导致风险后置。
由此可见,传统的注册监管流程已经很难适用于人工智能医疗器械。早在2019年器审中心就发布了《深度学习辅助决策医疗器械软件审评要点》,规定了深度学习辅助决策医疗器械软件的审评范围和监管重点,而后在2022年3月9日修订了《医疗器械软件注册审查指导原则》,同一天发布了《医疗器械网络安全注册审查指导原则》和《人工智能医疗器械注册审查指导原则》,在未来统一协调人工智能医疗器械相关要求迫在眉睫。
3、人工智能医疗器械相关指导原则、审评要点及标准
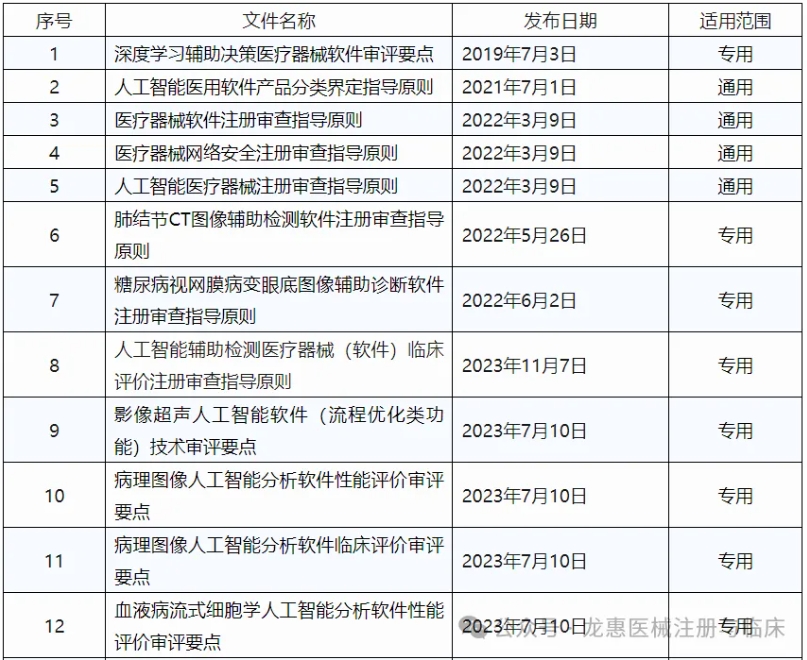
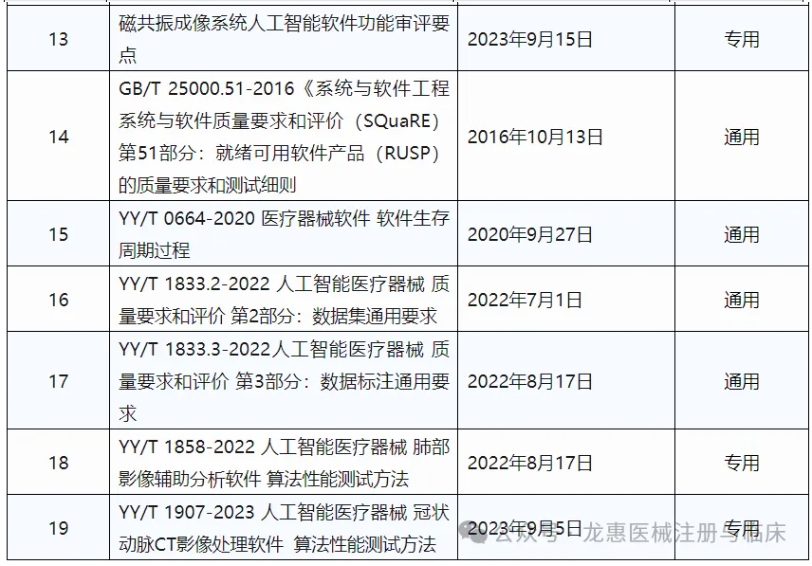
上表总结了国内已发布的有关人工智能医疗器械的指导原则,审评要点和推荐性国家标准、行业标准。其中,适用程度视产品的预期用途而定。
4、结合临床指南和专家共识
人工智能医疗器械的设计开发过程应充分考虑临床指南和专家共识的建议,明确自身产品参照哪些标准治疗方法或推荐方法,预期解决什么样的临床问题。持续保持研发的先进性和实用性,提高未来产品上市的临床价值。
