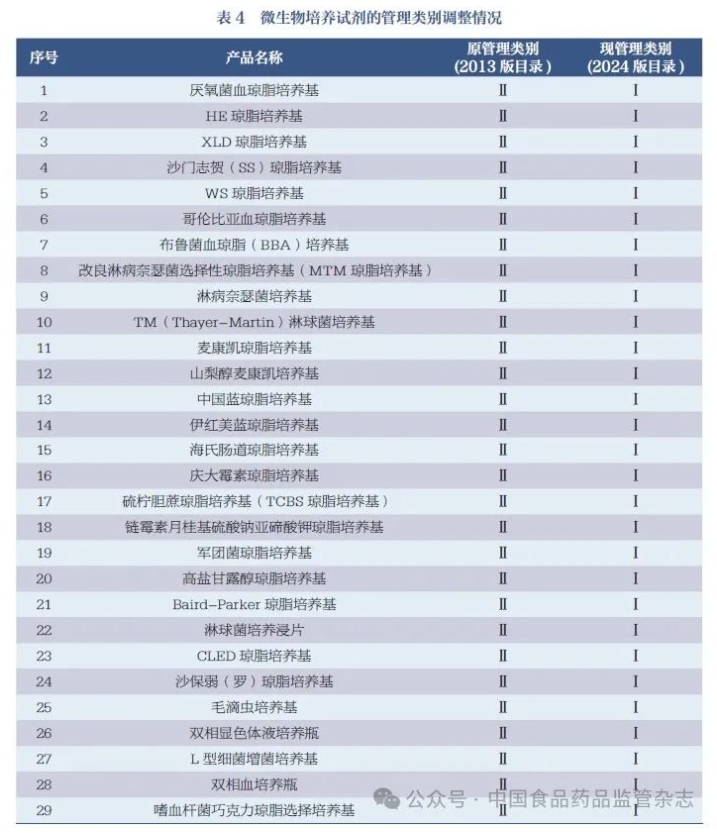
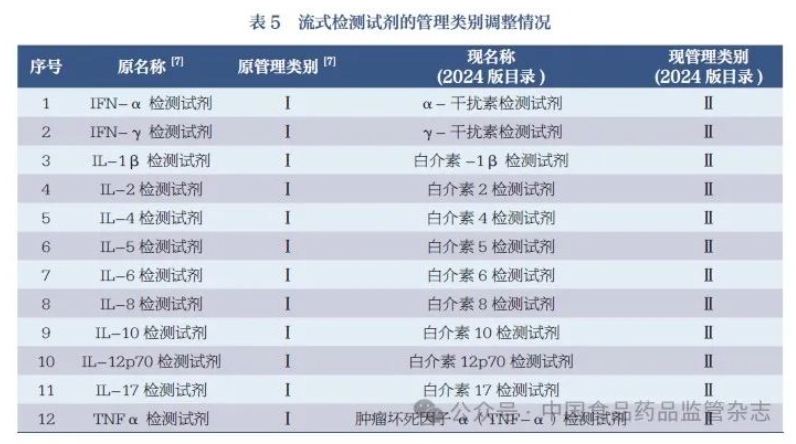
列入2024 版目录的IVD 产品是指按医疗器械管理的IVD 试剂。 公共卫生领域用于疫苗接种后免疫效果的监测及流行病学调查的产品、公安刑侦领域用于药物滥用现场筛查、生物恐怖事件样本的现场筛查的产品等,不符合《体外诊断试剂注册与备案管理办法》中“体外诊断试剂”定义,不列入目录。 依据《分类规则》,按照药品管理的用于血源筛查的IVD 试剂、采用放射性核素标记的IVD 试剂以及用于细胞治疗、细胞回输、辅助生殖等的细胞培养基类产品,不按医疗器械管理,不列入目录。 列入此一级产品类别的产品通常具体到特定致病性病原体;另外,特定致病性病原体的分泌物抗原、抗体检测试剂,也列入此类别按Ⅲ类管理,如艰难梭菌毒素A/ 毒素B 检测试剂、念珠菌甘露聚糖抗原/IgG 抗体检测试剂等。 在《关于过敏原类、流式细胞仪配套用、免疫组化和原位杂交类体外诊断试剂产品属性及类别调整的通告》中,人类白细胞抗原B27(HLA-B27) 检测试剂按Ⅲ类产品管理[7],但不符合2021 年发布的《分类规则》第六条要求,因此本次修订将除基因检测以外的HLA-B27 检测试剂由Ⅲ类调整为Ⅱ类。 2024 版目录中“05 与麻醉药品、精神药品、医疗用毒性药品检测相关的试剂”条目根据《麻醉药品和精神药品品种目录》(2013 版)、《医疗用毒性药品管理办法》(1988 版)所列的毒性药品品种以及后续补充文件增加的品种[26-33] 进行确定。 按照IVD 试剂管理的麻醉药品、精神药品、医疗用毒性药品检测相关的试剂侧重于定量,以进行治疗药物浓度监测和服用过量后的治疗指导为主要用途;而公安刑侦系统相关检测试剂侧重于定性,主要用于药物滥用筛查,以作为司法证据。 列入此一级产品类别的产品主要用于检测血液/ 体液中游离的蛋白质;细胞膜表面蛋白主要列入“19 用于其他生理、生化或免疫功能指标检测的试剂”。如果蛋白和蛋白降解产物分别都有检测项目,则宜视为不同分析物单列。例如N 端中段骨钙素为骨钙素(氨基酸1-49)被蛋白酶水解后的大片段(氨基酸1-43),目录中予以单列。 按《关于调整〈6840 体外诊断试剂分类子目录(2013 版)〉部分内容的公告》降为Ⅱ类的部分用于治疗监测、预后观察的肿瘤标志物[8],多数按成分归入按Ⅱ类管理的“08 用于蛋白质检测的试剂”等产品类别中,部分分别归于“10 用于激素检测的试剂”“11 用于酶类检测试剂”。 “血源细胞去除试剂”通常是循环肿瘤细胞检测、免疫细胞化学分析、构建基因组图谱等的前处理试剂,建议与配合的试剂盒一起打包注册,故未列入目录中。 芳香基硫酸酯酶检测试剂因从未获得注册证,未列入目录。 需要说明的是自身抗体谱检测试剂,此类产品系组合试剂,组合后没有新的预期用途出现,目录对其进行了拆分[34]。 产品类型主要包括凝血相关检测、体液有型成分检测、精液相关检测、细胞的膜表面分子检测[ 如白细胞抗原(HLA)]、细胞因子类检测、无需培养的微生物的生化检测(如幽门螺旋杆菌尿素酶检测试剂)等。5- 羟吲哚乙酸检测试剂虽有少数几个Ⅱ类注册证,但因临床预期用途不明确,未列入目录。 (1)微生物鉴别和药敏试剂的归类 用于环境样本检测的培养基,不符合《体外诊断试剂注册与备案管理办法》中“体外诊断试剂”定义,暂不列入目录。 《分类规则》中用于微生物鉴别或者药敏试验的试剂作为Ⅱ 类医疗器械管理。依据ISO11133:2014 Microbiology offood, animal feed and water —Preparation, production, storageand performance testing of culturemedia等文件,鉴别和鉴定的含义不同, 鉴别(differential)是在已知小范围内进行选择;鉴定(identification)是对更大范围的微生物的种类进行明确判断,鉴定的要求更高。此次目录修订,将微生物药敏试剂、部分鉴别功能较强的试剂(鉴定试剂)以及试验风险较高(如结核分枝杆菌培养)的试剂继续按Ⅱ类管理;其余风险较低的、通过营养成分或抗生素调节进行选择性培养的微生物培养基调整为Ⅰ类管理,共计29 个(表4)。 (2)细胞培养基的归类 目前细胞培养基在IVD 领域的应用主要是免疫细胞功能检测和产前筛查方面,细胞药敏检测技术仍在发展中。根据《分类规则》,列入目录的细胞培养基应明确用途限制(不用于细胞治疗、细胞回输、辅助生殖等非IVD 用途)。按照I 类管理的细胞培养基,仅保留基础培养基产品,如RPMI-1640 培养基、在基础培养基中添加动物源性血清[ 胎牛血清(FCS)、小牛血清(NBS)]形成的完全培养基。对于添加了细胞因子(白介素、干扰素、集落刺激因子、肿瘤坏死因子、生长因子、趋化因子等)、激素、细胞外基质、有丝分裂原等诱导成分的细胞培养基,统一按Ⅱ类管理。对于未界定但已备案的细胞培养基产品,如果明确了所培养的细胞类型、细胞来源,但不能明确其预期用途的,皆不列入目录,如上皮细胞培养基、肿瘤细胞培养基、结直肠细胞培养基、肝细胞培养基、骨髓细胞培养基等。另外, 鉴于细胞培养产品的监管现状,沿袭2013 版目录的条目“20071- 药敏接种培养液”“20072- 药敏指示剂”,仍只是配套全自动微生物鉴定药敏分析设备使用,不包含“细胞培养药敏检测”内容。 (1)前处理试剂。根据《分类规则》第六条和第七条,按照Ⅰ类管理的样本前处理试剂,主要指检测反应发生前的样本前处理阶段所用的通用性产品,且不参与反应。原则上此类产品仅包括仪器平台通用或方法学通用的样本处理用试剂,不包括针对具体检测项目的样本处理用试剂。如样本萃取液,为可跨平台、或同一仪器平台,或同一方法学使用的非特异性试剂,预期用于对待测样本进行分析前预处理,溶解细胞,萃取出待测物,其本身并不直接参与检测。 质谱类检测试剂的前处理试剂存在专用试剂按照通用试剂备案的情况,此次目录修订予以清理。非IVD 用途的试剂(如用于富血小板血浆治疗的“富血小板血浆样本提取试剂”)、组分描述不清的试剂(如使用诸如成分A、成分B、组分1、组分2 等替代性描述),皆不列入目录。 (2)染色液。按照I 类管理的染色液主要包括病理组织学染色、细胞学染色和微生物染色试剂,为通用性产品,是基于物理吸附着色,通常不含有可发生生化反应变色的试剂,不含特异性的蛋白、抗原、抗体、酶等物质。染色液产品名称较为混乱,化学成分存在异名较多情况,一般按主要化学成分或常用名称命名,如伊红染色液、结晶紫染色液等[38]。按使用习惯保留了少量2013版目录中以染色对象命名的染色液,如网状纤维染色液、弹性纤维染色液,但建议尽量使用主要化学成分命名。有基于尿素酶法的幽门螺旋杆菌染色液按I 类备案,不符合《分类规则》要求,应按Ⅱ类“19085- 幽门螺旋杆菌尿素酶检测试剂”进行管理。 按照Ⅰ类管理的反应体系通用试剂,主要指检测反应阶段维持反应体系环境的通用性试剂。仅包括仪器平台通用或方法学通用的反应体系试剂,例如化学发光免疫分析用底物液、化学发光免疫分析用发光液等,不针对具体检测项目,此类试剂基本是与自动化免疫分析设备平台配套使用。常规免疫检测试剂盒里的二抗成分不拆分单独备案。 2013 版目录中的病理“免疫染色液”统一改用“免疫显色试剂”,不同于化学染料的物理吸附着色,是通过一些免疫组织化学反应,让产物显出颜色。病理免疫显色试剂不包含一抗或首要探针,可包含二抗成分。 2013 版目录中的“清洗液/洗脱液”改名为“待测物清洗液/洗脱液”,用于检测过程中反应过程体系内待测物清洗或洗脱、起到纯化待测物以便后续检测的仪器平台通用或方法学通用试剂。不单独用于仪器、检测用具及环境的清洗。检验实验台面、消毒用品(如洁厕灵)、生活用品或洗鼻冲洗液、生理盐水等均不算此类,不能按IVD 试剂备案。 (1)预期用途中均限定不得用于指导临床用药或伴随诊断。 (2)单一抗体试剂、单一探针试剂是流式细胞仪用、免疫组化、原位杂交类病理检测产品分类界定的关键成分。按Ⅰ类管理的免疫显色试剂不能含有这些成分。 (3)根据《分类规则》,按照Ⅰ类管理的流式细胞仪用、免疫组化、原位杂交产品涉及抗体或者探针,均为“单一抗体”或“单一探针”。原位杂交产品中针对单个基因检测的断裂基因探针、融合基因探针,因其产品的特性,需要两个探针共同完成某个基因的检测,视作“单一探针”;原位杂交产品中针对单个基因检测的,产品的组成中除主要的特异性探针外,另含有起“辅助定位”作用的探针的(着丝粒探针),也视作“单一探针”[39]。 (4)根据《分类规则》,上述按照Ⅰ类管理的“单一抗体”或“单一探针”组合后,应当依据组合产品的临床预期用途按照Ⅱ类或Ⅲ类管理。 (5)随着流式微球、流式质谱等技术应用和概念的不断拓展,为避免将“流式”概念泛化,对按照Ⅰ类管理的流式产品进行了限制说明,限指对体液中悬浮的细胞进行分析的试剂,主要检测细胞膜表面分子。针对以特定“微珠”或者“微球”为载体,在流式平台上对白介素、干扰素、肿瘤坏死因子等可溶性细胞因子进行检测分析的试剂,则做了类别调整,见表5。