

资质脱节:国内注册人制度下,部分委托方(尤其是初创企业)缺乏质量管理体系落地能力,难以通过现场核查。
跨区域监管差异:各省药监局对受托方生产条件的审核标准不统一,增加合规风险。
强化资质穿透审核:委托方需实地考察受托方车间,并核对其《医疗器械生产许可证》范围是否包含产品分类(如Ⅱ类、Ⅲ类)。
动态合规监测:利用NMPA数据库跟踪受托方的飞检记录(如“生产环境不达标”等通报),通过第三方平台订阅法规更新(如新版《医疗器械生产质量管理规范》)。
国内现行法规虽明确注册人承担主体责任,但实际诉讼中常因合同约定不清导致连带责任争议。
合同细则:在协议中明确质量责任划分,例如“受托方未按工艺要求操作导致质量问题,承担70%赔偿责任”。
双重质量监督:委托方定期派员参与受托方内审,并保留关键工序(如无菌包装密封性测试)的实时视频记录。
某企业委托生产骨科植入物时,未完整转移热处理参数,导致产品力学性能不合格;国内药监局抽样检测发现问题后启动召回。
技术验证全流程化:实施 DQ(设计确认)→IQ(安装确认)→OQ(运行确认)→PQ(性能确认) 四阶段验证。
跨团队协作:建立联合技术小组,确保工艺文件(如作业指导书)经双方签字确认。
国内原材料市场鱼龙混杂,存在“阴阳合同”现象:受托方表面使用指定原料,实际偷换低价替代品。
供应商绑定与飞检:委托方直接指定原料供应商(如要求使用“迈瑞医疗专用医用级塑料”),并突击检查受托方来料仓库。
唯一标识追溯:对关键物料(如生物相容性涂层)加贴唯一码,通过扫码系统实现进销存全程追踪。
中小型受托企业自动化程度低,依赖人工操作(如手工焊接导管),易引发批次不一致。
数字化监管接入:部署工业物联网(IIoT),实时监控设备运行参数(如注塑机温度波动超出±2℃时自动预警)。
分级管理关键点:将灭菌、包装等高风险工序设为“必须驻厂监督”环节,其他工序按周抽检。
全链条数据贯通:打通双方ERP系统,实现生产批次与流通终端(医院、经销商)数据实时同步,响应国内UDI(唯一器械标识)政策要求。
召回压力测试:模拟“某批次血糖试纸精度超标”场景,要求受托方在24小时内提供受影响批次的全流向报告。
核心技术(如AI算法驱动的影像设备软件)易被受托方窃取或二次开发。
分阶段技术交付:核心代码分段加密传输,仅在受托方服务器封闭环境运行,禁止本地存储。
法律与技术双保险:合同中加入惩罚性赔偿条款(如侵权行为按实际损失3倍赔偿),并通过硬件加密狗限制生产设备非法复制。
跨国委托时,国内受托方对FDA、CE标准理解不足,导致出口产品遭退运。
标准对齐培训:针对目标市场(如欧盟MDR法规),委托方提供专项培训并参与受托方内部文件修订。
三方认证介入:引入国际检测机构(如SGS)对受托方生产线进行符合性预审。
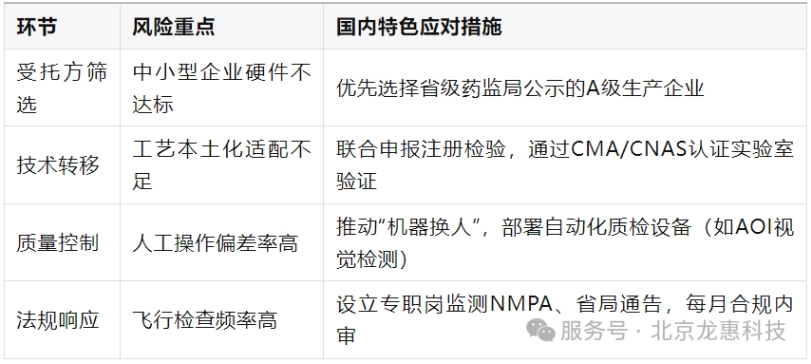
注: 企业可参考NMPA《医疗器械委托生产质量协议编制指南》,结合自身产品特性(如高风险III类器械需增加无菌保证条款)定制管理方案。
