止血材料在创伤救治和外科手术中扮演着至关重要的角色,可吸收止血产品是指在常规止血技术无效的情况下,在手术过程中放置于人体内的可被人体吸收的医疗器械产品,该类产品可通过加速创面局部血液的凝固过程产生止血作用。 目前该类产品大多由以下材质制成:氧化纤维素、再生氧化纤维素、淀粉等植物多糖,可吸收性明胶、胶原等。可吸收止血产品能够在体内逐渐降解,无需二次手术移除,减少了患者的痛苦和并发症风险
可吸收止血材料主要分为以下几类:
物理止血:通过形成屏障阻止血液流动,促进血液凝结。
生物止血:利用凝血酶将纤维蛋白原转化为纤维蛋白凝块。
混合型:结合物理止血材料和凝血酶,通过物理和生物双重机制止血。
纤维蛋白胶:提供高浓度的纤维蛋白原和凝血酶,加速血液凝块形成

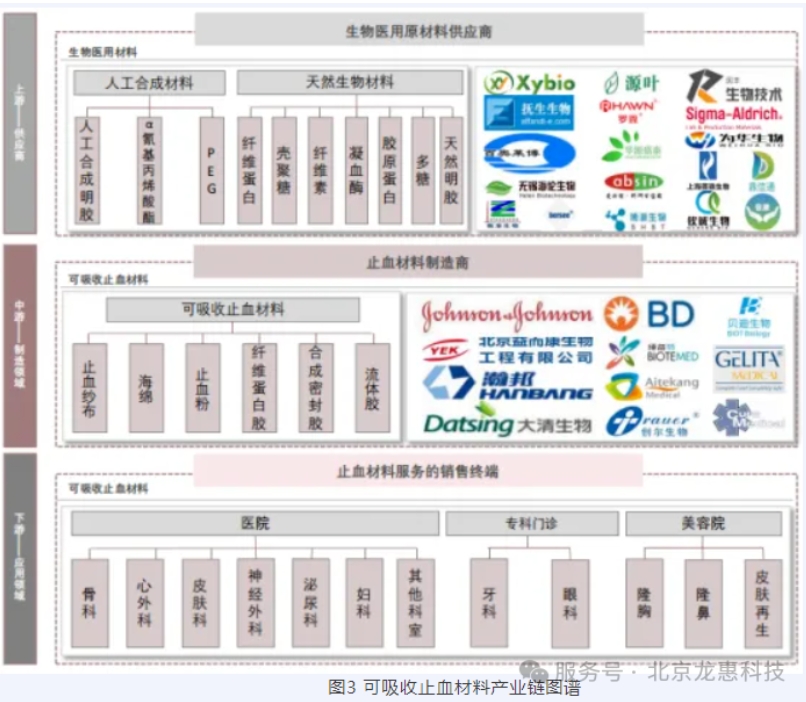
上游:主要包括人工合成材料和天然生物材料供应商,如纤维素、胶原蛋白、壳聚糖等。 中游:止血材料制造商,主要产品包括止血纱布、海绵、止血粉等。强生公司在中游市场占据主导地位,2021年全球销售额近70亿元人民币。 下游:应用领域广泛,涵盖医院、专科门诊和美容院的多个科室,如骨科、心血管外科、神经外科等。 强生爱惜康:其“速即纱”产品在市场上占据较大份额,尽管强生公司的“速即纱”占据了约三分之一的市场份额,但国产化进程仍有较大的发展空间。 本土厂商:如沪士达、创尔生物、贝迪生物等,主要生产止血海绵、止血粉等产品。 可吸收止血产品作为一类重要的医疗器械,其临床评价是确保产品安全性和有效性的关键环节。根据《医疗器械临床评价技术指导原则》、《可吸收止血产品注册审查指导原则(2024年修订版)》等相关法规,临床评价资料的设计和提交需遵循严格的规范。以下是可吸收止血产品临床评价的主要内容和要求: 临床试验分为探索性试验和确证性试验两个阶段: 探索性试验:适用于首次应用于人体的可吸收止血产品,主要目的是评估产品的安全性和可行性。试验设计应科学严谨,样本量一般不少于30例,重点关注安全性指标,同时记录有效性相关数据,为后续确证性试验提供参考。 确证性试验:在探索性试验基础上,进一步验证产品的有效性和安全性。建议采用对照、前瞻、随机性研究设计,将拟申报器械与已上市同类产品进行对比。 研究设计:建议申请者采用对照、前瞻、随机性研究设计,将拟申报器械与已获准上市器械进行对比。 比较类型:根据研究目的选择优效性检验、非劣效性检验或等效性检验。若以传统纱布按压作为对照,通常选择优效性检验。 研究假设:明确试验的主要假设,例如“对照器械应与拟申报器械采用类似的材料制成且具有相似的预期用途”。 适应症范围:详细说明试验对象的选择标准、入选条件和排除标准。 多适应症评估:若产品适用于多种外科手术,建议在3-4个不同手术类型中评估其性能。若产品选择在妇产科进行临床试验,入组患者时应考虑患者是否有妊娠生育要求。 特殊适应症:若拟申报产品标示有专业外科(如眼科、神经外科、泌尿外科)的适应症,建议申请者进行更多的对应研究以评估产品的性能,应选择特定的临床适应症患者进行临床试验。 明确临床性能评价指标,评价的指标应合理,并便于临床观察,评价指标应至少包括安全性(包括不良反应和研究器械相关的严重不良事件)指标和有效性指标(如:有效止血时间、止血成功率),对不良反应和禁忌症应有处理和预防措施,以减少患者的风险。 试验样品:详细说明产品的规格型号、批号、使用方法。 对照产品:选择与拟申报产品材料、预期用途相似的已上市产品作为对照,并注明其注册证号、生产厂家等信息。 随机化:采用中央随机系统(如IWR/IVR)或随机信封分配随机号,确保随机化的公正性。 病例登记:所有入组患者的基本信息应记录在中央计算机系统内,便于数据跟踪和核查。 数据管理:确保数据的完整性、准确性和可追溯性。 随机对照设计的试验,其主要终点有效率的组间比较,采用调整中心效应的CMH(Cochran Mantel-Haenszel)卡方检验,需给出试验组与对照组有效率的差值及其95%可信区间,其余终点指标参照基线分析进行。临床研究中有效性评价的临床终点应为一定时间内是否达到止血作用或达到止血作用所需的时间(如:5分钟止血时间)。 建议申请者对临床试验中纳入的患者进行随访,随访时限为拟申报器械被完全吸收的所需时间。此外,建议在器械的应用前和应用后评估血常规、血生化、免疫反应等的情况。随访应有客观依据。 中国止血材料行业仍处于上升期,尽管短期内受到疫情影响,但随着技术的进步和市场的拓展,未来几年将保持增长趋势。国产化进程和技术创新将是行业发展的关键。可吸收止血产品的临床评价是一个复杂而系统的过程,涉及试验设计、样本量计算、数据管理和统计分析等多个环节。通过科学的临床试验设计和严格的质量控制,可以全面评估产品的安全性和有效性,为产品的注册和上市提供可靠依据。