

为持续优化首都医疗器械产业营商环境,提高政务服务效率,市药监局于2024年11月上线新版行政许可系统,通过在系统中嵌入受理前服务、补正资料预审查等创新功能,成功缩短了申请人各类事项办理周期。
为进一步优化医疗器械审评审批服务,提升申请人注册申报效率,近日,市器械审查中心对申请人咨询较多的电子化申报问题进行总结归纳。结合梳理情况,本文将重点讲解补正资料预审查电子化申报功能。
01什么是补正资料预审查
补正资料预审查适用于已提交注册申请但需补充完善材料的产品,使用该功能可以及时获取补正材料的内容反馈,帮助企业提前完善材料,避免反复修改。
1. 适用情形:已发补且无法确认补正材料的合规性。
2. 服务优势: 专业指导:提供申报材料完整性、合规性专项辅导。 快速响应:自材料提交次日起20个工作日内出具书面指导意见(含补充材料建议)。 容错机制:对上传的材料可以再次修正,每个申报产品有两次补正预审查机会,可确定最终材料后提交正式补正,避免材料有误导致申报事项不予通过。
02补正资料预审查步骤详解
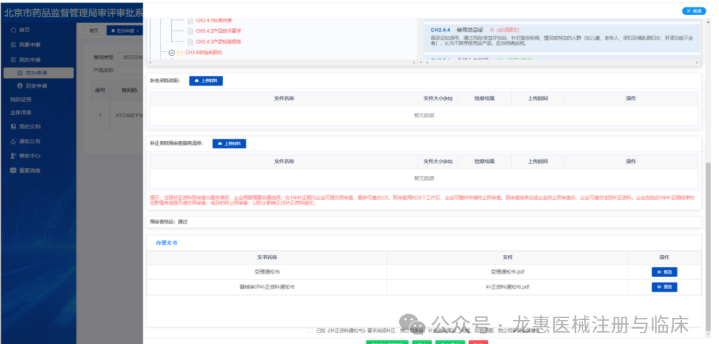
1.点击“我的申请”中在办申请菜单栏的“审评补正”,可查看注册资料的补正资料通知书。 2.依据补正资料通知书进行资料补正,并上传相关材料。点击“提交预审”进入补正资料预审查程序。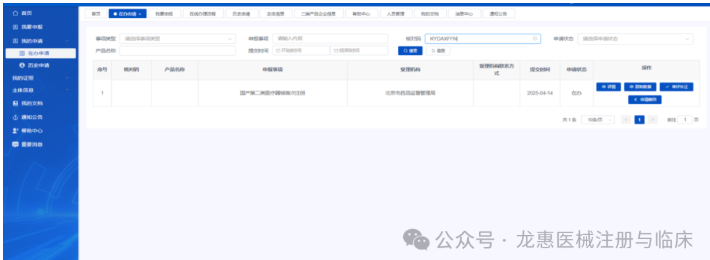
03服务支持
发补后如提交正式补正,需确认材料均已无误,与主审老师确认后可以提交最终版补正材料。如直接选择“正式补正”通道提交,一经确认将不可撤回或修改,请谨慎操作。
04重要提示
1. 系统操作疑问,请咨询服务热线:400-900-1866(工作日9:00-17:30)
2. 提交材料内容疑问,请咨询服务热线:010-55527147(工作日9:00-17:30) 3. 其他方式:京通小程序搜索“医疗器械审评咨询”,进入“北京器审咨询和预约系统”,选择网上问答咨询或预约现场沟通。 请各企业结合自身发展阶段,科学规划申报路径,充分发挥“预审查”服务效能。让我们携手构建“标准共商、过程共管、成果共享”的审评服务新生态,为促进首都医疗器械产业高质量发展注入新动能。
