

01、上海发布高端器械支持政策,八大领域迎利好
昨日(9月15日),上海市人民政府办公厅发布《上海市促进高端医疗器械产业全链条发展行动方案》(以下简称《方案》)(全文见文末)。

《方案》明确,到2027年,新增首次获批境内第三类医疗器械注册证超500件,新增在海外市场获批医疗器械产品超100件,培育年产值超100亿元、具备较强国际竞争力的龙头企业2家,建设高端医疗器械产业集聚区3个。
主要重点支持八大领域产品:
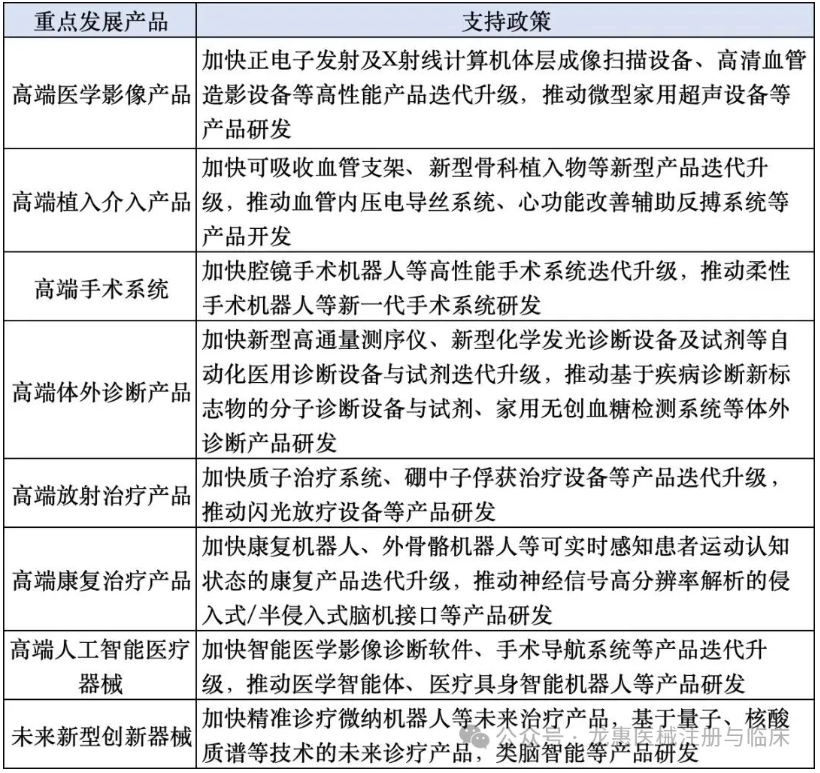
02、审评时限缩短,医保支付模式优化……七大重点任务公布
在重点任务上,《方案》提出七大侧重点,包括提升创新策源能级、强化临床赋能产业、优化审评审批服务、加速创新产品应用推广、培育壮大高能级企业、构建一流产业创新生态、推动产业国际化发展。
如加强肿瘤精准诊断与介入治疗、神经功能调控等研究;加快多重拉曼光谱成像、脊髓/脑超声功能成像等成像技术,高精度脑电信号解码、高密度微电极阵列等脑机接口技术,影像引导加速器系统等诊疗一体化技术攻关;
加快高性能影像设备用晶体材料、泛血管植入用镍钛材料等关键材料研制。加快医学影像设备用高端球管、脑机接口用超柔性电极等开发。加快高性能内窥镜核心零部件封装、心血管介入用高端球囊成型等核心工艺优化提升。
在审评审批上,对第二类、第三类创新医疗器械注册审评加强跨前指导服务。将第二类医疗器械审评平均时限压缩至40个工作日以内。支持取得进口或境内医疗器械注册证的企业在沪生产第二类、第三类医疗器械。
在支付端,优化产品支付模式。对已纳入医疗机构可另收费一次性使用医疗器械目录的“新优药械”产品,加快受理企业挂网采购申请。对入选应用示范项目但尚未纳入医疗机构可收费一次性使用医疗器械目录的医疗器械,鼓励医疗机构按照国家及我市相关医药价格管理规定提出收费建议。
同时,在DRG/DIP支付政策上予以支持。对创新医疗器械所涉及的诊疗项目,实行医保预算单列支付、在DRG/DIP改革中单独支付;按规定将相关高价值创新医疗器械、创新医疗服务项目,在DRG/DIP改革中独立成组、提高支付标准、不受高倍率病例数限制。
03、利好政策密集发布,医疗器械创新支持覆盖全链条
连日来,药械创新支持政策密集发布,在审评审批、资金投入、入院支付等多方面给予支持。如海南省发布了《关于进一步支持生物医药产业高质量发展的若干政策措施》,鼓励企业参与国家带量采购,对参加国家药械集中带量采购中标品种,按照以中标单价完成实际销售额的3%给予最高300万元奖励;鼓励省内外企业依法兼并重组本省医药企业,就地盘活资产、发展壮大,对参与兼并重组产生的银行贷款给予50%的贴息,连续贴息2年,最高补贴500万元。
广西工信厅发布《关于推动广西生物医药产业高质量发展若干政策措施(征求意见稿)》,对新取得国家药品或医疗器械注册批件、落地实现产业化生产的企业,按注册分类和产业化规模的一定比例给予支持。其中,给予第三类医疗器械不超过100万元的支持;给予纳入自治区级及以上创新审批通道的医疗器械不超过30万元的支持。
国家层面近期也释放出创新器械利好信号。2025年7月,国家医保局聚焦医保支持创新药械主题连续召开五场座谈会,五场座谈会覆盖创新医疗器械发展的全链条,其中包括国家政策、企业研发、产品应用、医保支付等具体内容。
今年7 月,国家药监局发布《关于优化全生命周期监管支持高端医疗器械创新发展的举措》,围绕高端医疗器械构建了贯穿研发、审批、上市、监管、国际化全链条的创新支持体系。
观察来看,国家层面对医疗器械创新的政策支持呈现全链条、系统性覆盖的趋势,从研发、生产到使用和支付环节均给予了明确的支持,具备真正自主创新能力的器械企业将长期获益。
