2015年,在临床试验行业界,对于国内药企,传得沸沸扬扬的除开国家局的大动作核查,就是撤销;对于外资背景药企,除了自查就是遗传办的流程落实。
那么我们看扒一扒这个神秘的“遗传办”和临床试验相关的内容。
1 什么是遗传办?
遗传办全称为:中国人类遗传资源管理办公室。
全国人类遗传资源由国务院科学技术行政主管部门和卫生行政主管部门共同负责管理,并联合成立遗传办,暂设在国务院科学技术行政主管部门。
各省、自治区、直辖市科学技术行政主管部门和卫生行政主管部门(以下简称地方主管部门)负责本地区的人类遗传资源管理工作。
这一点很重要,涉及到相关的流程该找谁给审核意见和盖章。
“人类遗传资源采集、收集、买卖、出口、出境审批”有关部门、省级科技行政主管部门联系电话:
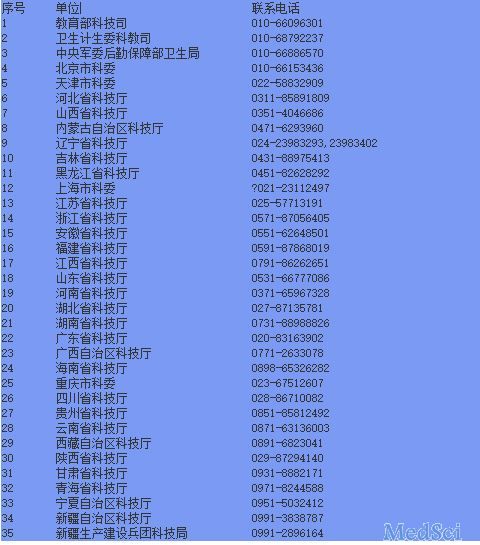
这个行政许可适用于对在中国境内从事的中国人类遗传资源采集、收集、买卖、出口、出境等事项的规范和管理。
采集适用于涉及中国境内人类遗传资源,包括重要遗传家系和特定地区人类遗传资源的采集活动;
收集适用于以保藏或国际合作为目的的人类遗传资源的收集活动;按照国家相关法律法规规定禁止人类遗传资源买卖,以科研为目的的人类遗传资源转移不属于买卖;
出口、出境适用于将人类遗传资源转移到境外的情形。
那么,临床试验是属于收集这一分类。
根据《暂行办法》的规定,人类遗传资源是指含有人体基因组、基因及其产物的器官、组织、细胞、血液、制备物、重组脱氧核糖核酸(DNA)构建体等遗传材料及相关的信息资料。
这里有两个问题需要注意:
如果内资药企发起的临床多中心药物试验,采集、收集环节没有外资参与,根据实际情况:如果采集环节不涉及特定地区和重要遗传家系,没有以保藏为目的的收集活动,实体样本和数据不出口出境,则无需申报。反之,如果涉及受理范围的,则需要申报。
如果内资药企发起的临床多中心药物试验,但是临床遗传材料实体样本和(或)有关数据收集交由外资CRO承担,这种内资药厂与外资CRO之间为国际合作,应先报批再开展。
2研究申请材料
申请材料清单
序号 | 提交材料名称 | 原件/复印件 | 份数 | 纸质/电子 | 要求 | 备注 |
1 | 申请书 | 原件 | 1 | 纸质和电子 | 网上申报填写后,纸质盖章提交 | 开展采集、收集、出口出境活动均需提交 |
2 | 组织机构代码证 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境活动均需提交 |
3 | 知情同意书 | 复印件 | 1 | 纸质和电子 | 开展采集、收集、出口出境活动均需提交 | |
4 | 伦理委员会同意批件 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境活动均需提交 |
5 | 采集、收集、转运合作协议文本草案 | 复印件 | 1 | 纸质和电子 | 纸质 | 开展采集和收集活动需提供 |
6 | 国际合作协议文本草案 | 复印件 | 1 | 纸质和电子 | 纸质 | 如有外方参加需提供 |
7 | 食品药品监管总局出具的临床试验批件(CFDA) | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 涉及注册用药物或医疗器械临床试验的项目需提供 |
8 | 法律法规要求的其他材料 | 复印件 | 1 | 纸质和电子 | 纸质盖章 | 开展采集、收集、出口出境活动均需提交 |
注意咯:上面是要拿到伦理批件才能去申请审批的,也就是说需要伦理批件出了之后,继续收集资料(合同是草稿就行了)走申请流程,同时着手洽谈合同。有些医院需要批件出来之后,见到审批结果了才给签合同,合同签署完之后,再拿去换审批结果,这样按部就班,时间就在这不经意之间溜走了。
申请人通过网上申请平台提交电子版申请材料,纸质材料可通过窗口报送或邮寄方式提交:
1.网上申请系统链接:http://www.cncbd.org.cn/TColumn/Detail/3428;
2.窗口报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心);
3.邮寄报送:科技部行政审批受理窗口(地址:北京市海淀区西四环中路16号院4号楼,科技部中国生物技术发展中心;邮编:100039;电话:010-88225151)
凡是遇到高科技的网上系统,总是不顺的。同样,我们的网上申请系统也不能用,只能用传统的老方法来代替。
申请单位是以医院为主体,并找到其上级主管临床项目的部门。注意,不是上级卫生管理部门哦,是科技行政主管部门。省归省、部归部,别跑错了门哦,否则下面的流程就迂回曲折。咱来看下公布的审批结果就明了了。
本行政许可按照一般程序办理,包括申请、受理、技术评审、决定和文书送达等。
(一)网上申请
申请人通过“人类遗传资源采集、收集、买卖、出口、出境审批”网上申请平台提交电子版申请材料。
(二)网上预受理
遗传办收到申请人在线提交的电子版申请材料后,在5个工作日内完成审查。对申请材料齐全、符合规定形式的,通知申请人打印纸质材料;申请材料不齐全或不符合要求的,通过网上申请平台一次性书面告知申请人需要补正的全部内容。
(三)纸质申请材料递交
申请人将网上预受理的电子版申请材料打印后,按隶属关系报国务院有关部门或当地省级科技主管部门,经审查同意后,向遗传办递交纸质申请材料。
(四)纸质材料审查与受理
遗传办收到申请人递交的纸质申请材料后,在5个工作日内完成形式审查,对申请材料齐全、符合规定形式的申请,予以正式受理并出具受理单。申请材料不齐全或不符合规定形式的,退回申请人。
(五)技术评审
遗传办从人类遗传资源管理专家组中选取专家,对受理的申请项目进行技术评审,形成专家评审意见。
(六)办公会审批
遗传办召开办公会,审核专家评审意见,做出批准或不批准的决定。
(七)结果公开
遗传办以书面文件形式通知申请人,抄送其行政主管部门,并将审批结果在科技部网站公示。
(八)证书送达
申请人凭受理单前往行政审批受理窗口领取审批书或受理窗口以邮寄方式将审批书送达。
(九)出口、出境证明办理
涉及人类遗传资源出口、出境的申请,按照遗传办批准的样品出境计划填写中国人类遗传资源材料出口、出境申报表(模版),提交遗传资源提供者签署的知情同意书(复印件),经遗传办审核后办理人类遗传资源材料出口、出境证明。



 2020-08-06
2020-08-06




 快速检索
快速检索 微信公众号
微信公众号
 官方百家号
官方百家号
 官方头条号
官方头条号
 官方微博
官方微博






