

5月19日,国家药监局发布10份征求意见稿向社会公开征求意见,涉及医疗器械注册申报、临床评价技术指导、体外诊断试剂分类规则等方面。
4份文件聚焦体外诊断
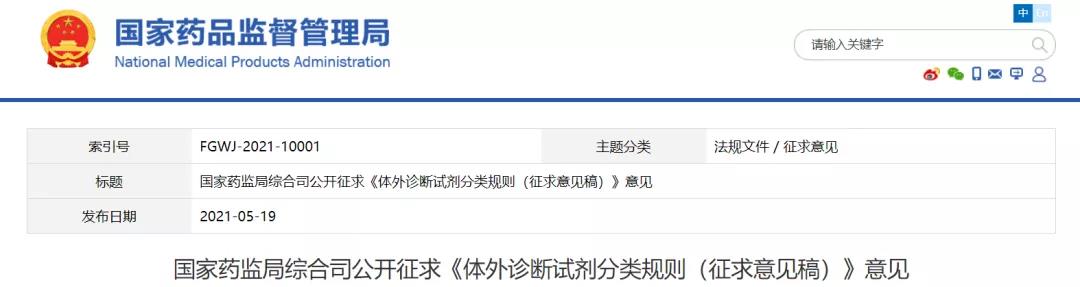
在体外诊断试剂方面,国家药监局发布4项征求意见,包括《体外诊断试剂分类规则(征求意见稿)》《体外诊断试剂注册申报资料要求和批准证明文件格式(修订草案征求意见稿)》《体外诊断试剂临床试验指导原则(征求意见稿)》《免于进行临床试验的体外诊断试剂方法学比对技术指导原则(征求意见稿)》。
文件分别从体外诊断试剂分类规则,申报资料形式、签章和公证及电子文档要求,体外诊断试剂临床试验设计、质量管理,以及免于进行临床试验的体外诊断试剂进行方法学比对的技术指导等方面向社会公开征求意见。
意见征求至5月31日
本次公开征求意见的其余6份文件为《医疗器械注册申报资料要求和批准证明文件格式(修订草案征求意见稿)》《医疗器械临床评价技术指导原则(征求意见稿)》《医疗器械等同性论证技术指导原则(征求意见稿)》《决策是否开展医疗器械临床试验技术指导原则(征求意见稿)》《医疗器械注册申报临床评价报告技术指导原则(征求意见稿)》《免于进行临床评价医疗器械目录(征求意见稿)》,以进一步完善《医疗器械监督管理条例》配套规章的制修订工作
国家药监局官网信息显示,本次意见征求截止至2021年5月31日。
